文章出處:公告通知 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2025-04-08
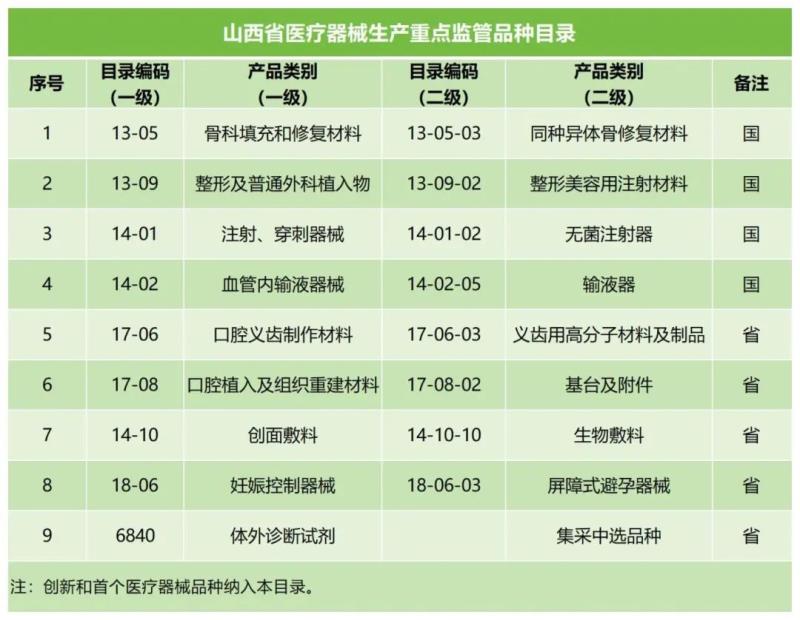
近日,山西省藥監(jiān)局發(fā)布《關(guān)于印發(fā)2025年山西省“兩品一械” 監(jiān)督檢查計劃的通知》,共包含《2025年度山西省藥品生產(chǎn)領(lǐng)域監(jiān)督檢查計劃》《2025年度山西省醫(yī)療器械臨床試驗機(jī)構(gòu)監(jiān)督檢查計劃》《2025年山西省醫(yī)療器械生產(chǎn)企業(yè)監(jiān)督檢查計劃》《2025年山西省醫(yī)療器械經(jīng)營使用環(huán)節(jié)監(jiān)管工作要點》《2025年度山西省化妝品監(jiān)督檢查計劃》5個附件,其中《2025年山西省醫(yī)療器械生產(chǎn)企業(yè)監(jiān)督檢查計劃》明確了檢查的重點企業(yè)、重點產(chǎn)品和重點內(nèi)容,并以附件形式列出了醫(yī)療器械生產(chǎn)9大重點監(jiān)管品種,還列出了山西省醫(yī)療器械生產(chǎn)企業(yè)分級監(jiān)管清單(四級監(jiān)管30家、三級監(jiān)管100家、二級監(jiān)管146家),其中9大重點監(jiān)管品種具體如下:
《2025年山西省醫(yī)療器械生產(chǎn)企業(yè)監(jiān)督檢查計劃》全文如下:
為貫徹落實全國醫(yī)療器械監(jiān)督管理工作會議和全省藥品監(jiān)督管理工作會議精神,進(jìn)一步加強(qiáng)全省醫(yī)療器械生產(chǎn)企業(yè)質(zhì)量安全監(jiān)管,結(jié)合我省實際,現(xiàn)就2025年醫(yī)療器械生產(chǎn)企業(yè)監(jiān)督檢查工作安排如下:
一、工作目標(biāo)
深入貫徹實施《醫(yī)療器械監(jiān)督管理條例》,強(qiáng)化風(fēng)險管控理念,嚴(yán)格全過程監(jiān)管,全面做好醫(yī)療器械生產(chǎn)監(jiān)管工作,進(jìn)一步督促企業(yè)全面落實質(zhì)量安全主體責(zé)任,提升企業(yè)質(zhì)量管理水平,持續(xù)保證醫(yī)療器械質(zhì)量安全,保障公眾健康和生命安全,助推醫(yī)療器械產(chǎn)業(yè)高質(zhì)量發(fā)展。
二、檢查依據(jù)
《醫(yī)療器械監(jiān)督管理條例》、《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》、《藥品醫(yī)療器械飛行檢查辦法》、《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》(以下簡稱《規(guī)范》)及其附錄和現(xiàn)場檢查指導(dǎo)原則、以及省局《醫(yī)療器械生產(chǎn)分級監(jiān)管實施辦法》等。
三、檢查重點
(一)檢查的重點企業(yè)
1.產(chǎn)品列入國家和省重點監(jiān)管目錄的生產(chǎn)企業(yè),四級監(jiān)管和三級監(jiān)管的醫(yī)療器械生產(chǎn)企業(yè);?
2.2024年度各專項檢查和飛行檢查中發(fā)現(xiàn)問題較多的醫(yī)療器械生產(chǎn)企業(yè);
3.監(jiān)督抽檢不合格或發(fā)生不良事件較多或收到投訴舉報較多或輿情監(jiān)測中反映問題較多的醫(yī)療器械生產(chǎn)企業(yè);
4.醫(yī)療器械注冊人、備案人委托生產(chǎn)及受托生產(chǎn)企業(yè)。
(二)檢查的重點產(chǎn)品
1.國家和省級重點監(jiān)管醫(yī)療器械目錄的產(chǎn)品;
2.創(chuàng)新醫(yī)療器械產(chǎn)品;
3.集采中選產(chǎn)品;
4.青少年近視防治相關(guān)醫(yī)療器械;
5.避孕套、輔助生殖醫(yī)療器械和殘疾人輔助醫(yī)療器械。
(三)檢查的重點內(nèi)容
檢查的重點內(nèi)容包括:
1.企業(yè)質(zhì)量管理體系自查報告及運(yùn)行情況;
2.醫(yī)療器械注冊人是否按照強(qiáng)制性標(biāo)準(zhǔn)以及經(jīng)注冊或者備案的產(chǎn)品技術(shù)要求組織生產(chǎn),質(zhì)量管理體系運(yùn)行是否持續(xù)合規(guī)、有效,是否按照質(zhì)量管理規(guī)范要求開展上市放行,是否按照要求對受托生產(chǎn)企業(yè)生產(chǎn)活動進(jìn)行有效管理。
3.貼敷類醫(yī)療器械生產(chǎn)企業(yè)是否按照經(jīng)注冊或者備案的技術(shù)要求組織生產(chǎn),是否擅自添加中藥、化學(xué)藥物等發(fā)揮藥理學(xué)、免疫學(xué)、代謝作用的成分;《第一類醫(yī)療器械產(chǎn)品目錄》過渡期后,是否仍按第一類醫(yī)療器械生產(chǎn)醫(yī)用冷敷貼、液體敷料等產(chǎn)品。
4.企業(yè)對原材料的采購管理情況,主要材料和輔料的來源及供應(yīng)商資質(zhì)確認(rèn)的程序和文件,采購記錄必須滿足可追溯要求;
5.企業(yè)生產(chǎn)檢驗的能力、生產(chǎn)檢驗設(shè)備的配備和完好;
6.嚴(yán)查生產(chǎn)過程特別是關(guān)鍵工序、特殊過程的質(zhì)量風(fēng)險控制點,確保與產(chǎn)品注冊批準(zhǔn)的技術(shù)要求一致;
7.產(chǎn)品批號管理程序以及入庫和留樣情況,生產(chǎn)記錄可追溯情況;
8.產(chǎn)品放行必須按照放行程序,滿足放行條件和檢驗規(guī)程的要求;
9.企業(yè)是否建立不良事件監(jiān)測和再評價制度,是否配備機(jī)構(gòu)和人員開展不良事件監(jiān)測和再評價工作等。
10.委托或受托企業(yè)是否按照國家局有關(guān)規(guī)定開展生產(chǎn)活動。
四、工作任務(wù)
省局負(fù)責(zé)組織實施全省醫(yī)療器械生產(chǎn)企業(yè)的監(jiān)管工作。醫(yī)療器械監(jiān)管處組織對列入四級監(jiān)管醫(yī)療器械生產(chǎn)企業(yè)開展合規(guī)檢查;檢查分局負(fù)責(zé)轄區(qū)內(nèi)四、三、二級監(jiān)管醫(yī)療器械生產(chǎn)企業(yè)日常監(jiān)督檢查,配合省局完成相關(guān)檢查工作;省藥品檢查中心對列入三、二級監(jiān)管醫(yī)療器械生產(chǎn)企業(yè)開展合規(guī)檢查,配合省局完成相關(guān)檢查工作。各市、綜改示范區(qū)局負(fù)責(zé)轄區(qū)內(nèi)第一類醫(yī)療器械生產(chǎn)企業(yè)監(jiān)督檢查工作。
(一)對列入四級監(jiān)管醫(yī)療器械生產(chǎn)企業(yè)每年進(jìn)行不少于一次全項目檢查;
(二)對列入三級監(jiān)管醫(yī)療器械生產(chǎn)企業(yè)進(jìn)行不少于一次監(jiān)督檢查,其中每兩年全項目檢查不少于一次;
(三)對列入二級監(jiān)管醫(yī)療器械生產(chǎn)企業(yè)每兩年檢查不少于一次;?
(四)對列入一級監(jiān)管醫(yī)療器械生產(chǎn)企業(yè)每年隨機(jī)抽取25%以上企業(yè)開展檢查。
五、工作要求
(一)落實監(jiān)管職責(zé),強(qiáng)化監(jiān)督檢查。要充分認(rèn)識加強(qiáng)生產(chǎn)環(huán)節(jié)監(jiān)管的重要性、必要性,落實監(jiān)管責(zé)任,明確責(zé)任分工,細(xì)化行動方案,突出監(jiān)督檢查重點,提高監(jiān)管效能,確保監(jiān)督檢查落到實處。
(二)強(qiáng)化風(fēng)險會商,提升防控水平。要進(jìn)一步聚焦風(fēng)險、聚焦產(chǎn)品、聚焦企業(yè)、聚焦處置,每季度開展安全形勢分析和風(fēng)險會商工作,風(fēng)險會商要有實效,要能夠及時有效地發(fā)現(xiàn)問題、解決問題,最大限度管控風(fēng)險,確保不發(fā)生系統(tǒng)性、區(qū)域性風(fēng)險。
(三)創(chuàng)新檢查模式,提升檢查質(zhì)效。要認(rèn)真貫徹落實國辦54號改革文件要求,做好監(jiān)督檢查工作統(tǒng)籌,檢查資源整合,合并檢查事項,防止重復(fù)檢查、多頭檢查,既要防止檢查過多和執(zhí)法擾企,又要保證必要的檢查有效開展。對許可檢查、合規(guī)檢查、日常檢查實施聯(lián)合檢查;對第二、三類醫(yī)療器械生產(chǎn)企業(yè)同時生產(chǎn)第一類醫(yī)療器械的,實施省市聯(lián)合檢查;對申報停產(chǎn)的企業(yè)探索開展遠(yuǎn)程檢查,結(jié)合企業(yè)報告情況確認(rèn)企業(yè)實際狀態(tài);推廣運(yùn)用“穿透式、審計式”檢查方法,創(chuàng)新“信息化+監(jiān)管”數(shù)字監(jiān)管模式,不斷提升檢查效能。
(四)嚴(yán)格檢查程序,提高監(jiān)管效率。要按照《規(guī)范》及其附錄和現(xiàn)場檢查指導(dǎo)原則的規(guī)定,嚴(yán)格現(xiàn)場檢查程序,規(guī)范檢查行為和記錄。檢查工作必須使用國家藥品智慧監(jiān)管平臺(網(wǎng)址:https://zhjg.nmpa.gov.cn/),在平臺上完成任務(wù)下達(dá)、檢查方案制定、檢查報告上傳等工作;同時使用省局“智慧監(jiān)管”一體化系統(tǒng)進(jìn)行計劃制定、檢查實施等,提高監(jiān)管工作效能。
(五)按時報送信息,注重經(jīng)驗總結(jié)。各市、綜改示范區(qū)市場監(jiān)督管理局、檢查分局和省藥品檢查中心應(yīng)在2025年11月30日前完成相應(yīng)工作,每季度末填報統(tǒng)計表格(見附件5),并加蓋公章將紙質(zhì)版和電子版報送省局醫(yī)療器械監(jiān)管處,并于6月25日、11月30日前將半年、全年工作總結(jié)及匯總表以書面和電子郵件兩種方式報省局醫(yī)療器械監(jiān)管處。總結(jié)報告應(yīng)當(dāng)包括生產(chǎn)企業(yè)監(jiān)督檢查情況,檢查發(fā)現(xiàn)的主要問題、處理措施、相關(guān)意見和建議等。
信息來源:山西省藥監(jiān)局
排版整理:金飛鷹藥械
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052 重慶:135-0283-7139