文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-08-05
隨著互聯(lián)網(wǎng)在醫(yī)療器械領(lǐng)域的廣泛應(yīng)用,全球各地監(jiān)管部門對醫(yī)療器械網(wǎng)絡(luò)安全提出了越來越嚴(yán)格的要求。近期我們輔導(dǎo)的FDA 510(k)案例中,也有不少產(chǎn)品是需要提交網(wǎng)絡(luò)安全資料的(如肺功能測試儀),那么本期文章我們就來分享一下:提交FDA 510(k)申請時,哪些情形下必須遞交網(wǎng)絡(luò)安全文件?
在2022年簽署的《2023年綜合撥款法案》(the Consolidated Appropriations Act, 2023)中,第3305節(jié)-“確保醫(yī)療設(shè)備的網(wǎng)絡(luò)安全”通過增加第524B節(jié)“確保設(shè)備的網(wǎng)絡(luò)安全”修訂了《聯(lián)邦食品、藥品和化妝品法案》(即FD&C法案)。根據(jù)FD&C法案第524B(a)條,對于符合FD&C法案第524B(c)條中定義的“網(wǎng)絡(luò)設(shè)備”的器械,必須滿足該法案的要求,以確保網(wǎng)絡(luò)器械符合FD&C法案第524B的網(wǎng)絡(luò)安全要求。
根據(jù)FD&C法案524B(c)將“網(wǎng)絡(luò)設(shè)備”(cyber device)定義為:
① 制造商作為設(shè)備或在設(shè)備中驗(yàn)證、安裝或授權(quán)的軟件; ② 具備連接互聯(lián)網(wǎng)的能力; ③ 包含經(jīng)申請人驗(yàn)證、安裝或授權(quán)的可能受到網(wǎng)絡(luò)安全威脅的技術(shù)特征。
2024年3月,F(xiàn)DA又發(fā)布指南草案Select Updates for the Premarket Cybersecurity Guidance: Section 524B of the FD&C Act,以對現(xiàn)有指南“醫(yī)療器械網(wǎng)絡(luò)安全:質(zhì)量體系考量和上市前提交內(nèi)容”提出選擇更新。該草案中列舉了(包括但不限于)能夠連接到互聯(lián)網(wǎng)的以下設(shè)備:
① Wi-Fi或蜂窩網(wǎng)絡(luò); ② 網(wǎng)絡(luò)、服務(wù)器或云服務(wù)提供商連接; ③ 藍(lán)牙或低功率藍(lán)牙; ④ 射頻通信; ⑤ 感應(yīng)通信; ⑥ 能夠連接互聯(lián)網(wǎng)的硬件連接器(如USB、以太網(wǎng)、串口)。
根據(jù)FD&C法案第524B(a)節(jié),任何人(包括制造商)以510(k)、De Novo、HDE、PDP和PMA路徑提交符合524B (c)中“網(wǎng)絡(luò)設(shè)備”定義的產(chǎn)品的上市前申請,均需遞交相關(guān)網(wǎng)絡(luò)安全資料,以自證確保該設(shè)備符合FD&C法案第524B (b)中關(guān)于網(wǎng)絡(luò)安全的要求。
FDA官網(wǎng)指出,如果制造商不確定設(shè)備是否屬于“網(wǎng)絡(luò)設(shè)備”,可以向FDA進(jìn)行咨詢。
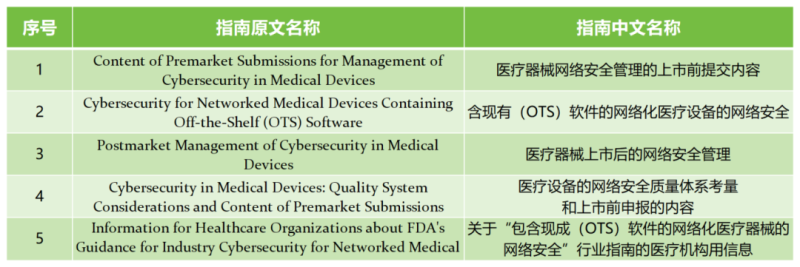
了解完需要遞交網(wǎng)絡(luò)安全文件的情形,我們整理了FDA發(fā)布的部分與網(wǎng)絡(luò)安全有關(guān)的(包括上市前和上市后)指南文件,以供大家參考:
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052