文章出處:行業(yè)干貨 網(wǎng)責任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-03-01
《醫(yī)療器械監(jiān)督管理條例》第二十五條明確規(guī)定:“進行醫(yī)療器械臨床評價,可以根據(jù)產(chǎn)品設計特征、臨床風險、已有臨床數(shù)據(jù)等情形,通過開展臨床試驗,或者通過對同品種醫(yī)療器械臨床文獻資料、臨床數(shù)據(jù)進行分析評價,證明醫(yī)療器械安全、有效”。
同品種臨床評價是臨床評價的一種路徑,是通過同品種產(chǎn)品的臨床數(shù)據(jù)完成申報產(chǎn)品的臨床評價,今天我們就來聊一聊同品種臨床評價的相關要點。
1、同品種臨床評價是臨床評價,還是臨床前研究的對比?
2、除了轉(zhuǎn)移生產(chǎn)、技術轉(zhuǎn)讓、基于上一代產(chǎn)品的改進,大多數(shù)情形下申報產(chǎn)品與同品種產(chǎn)品從原材料、生產(chǎn)過程到設計均存在不同程度的差異,如何認為申報產(chǎn)品與同品種產(chǎn)品等同?
3、同品種產(chǎn)品已經(jīng)過上市前評價準予上市,為何還要求申報產(chǎn)品的申請人收集同品種產(chǎn)品的臨床數(shù)據(jù)并進行分析評價?
為了回答這些問題,我們一起來看一下同品種評價的4個關鍵步驟:
1、同品種產(chǎn)品的選擇:當對比器械的適用范圍、技術和/或生物學特性與申報產(chǎn)品具有廣泛相似性時,可將其視為同品種醫(yī)療器械,這其中又包括等同器械和可比器械兩種情形。
2、申報產(chǎn)品與同品種產(chǎn)品進行對比:若完全相同,按3、同品種產(chǎn)品臨床數(shù)據(jù)走;若存在差異,按4、差異性部分的安全有效性證據(jù)走。那么在步驟2,3,4中可能會存在以下問題:我要對比什么項目?對比多少算充分?
3、同品種產(chǎn)品臨床數(shù)據(jù):提交的目的是什么?提交多少算充分?
4、差異性部分的安全有效性證據(jù):非臨床證據(jù)就夠了?還是一定要提交臨床證據(jù)?
(1)選擇目的:使用同品種產(chǎn)品的臨床數(shù)據(jù),開展申報產(chǎn)品的臨床評價(借用數(shù)據(jù)、實現(xiàn)數(shù)據(jù)外推來完成申報產(chǎn)品的臨床評價);
(2)如何選擇:與申報產(chǎn)品更為相似的產(chǎn)品(對申請者、監(jiān)管方都是最小負擔);
(3)如何看待多個同品種產(chǎn)品:共同證明申報產(chǎn)品的安全有效性(證據(jù)集合)。
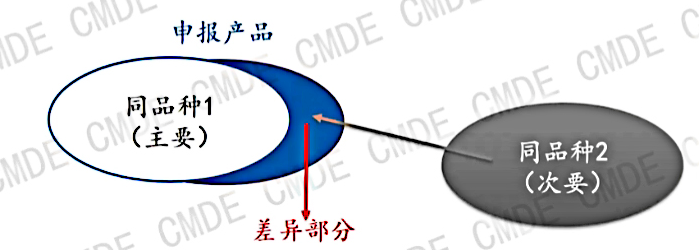
如圖所示,當申報產(chǎn)品和同品種產(chǎn)品存在差異的時候,我們可能會引入第二個同品種產(chǎn)品即“同品種2”作為差異性的證據(jù),這個時候我們需要關注的是,不同的設計特征適用范圍在申報產(chǎn)品中組合時不應相互影響。
參考法規(guī):《醫(yī)療器械臨床評價技術指導原則》。
一、技術特征
1.基本原理
2.結(jié)構(gòu)組成
3.生產(chǎn)工藝
4.制造材料
5.性能要求
6.軟件核心功能
7.安全性評價
8.符合的國家/行業(yè)標準
二、適用范圍及禁忌癥
9.適用范圍:1)適用人群;2)適用部位;3)與人體接觸方式;4)適應癥
10.禁忌癥
三、產(chǎn)品說明書臨床使用信息
11.使用方法
12.防范措施和警告
13.交付狀態(tài)(滅菌/消毒)
14.包裝
15.標簽
16.產(chǎn)品說明書
開展同品種臨床評價的,如使用了同品種產(chǎn)品非公開數(shù)據(jù)(如生產(chǎn)工藝、臨床數(shù)據(jù)等),申請人應提交使用授權書,以保證數(shù)據(jù)來源的合法性;使用公開發(fā)表的數(shù)據(jù),如公開發(fā)表的文獻、數(shù)據(jù)、信息等,不需取得授權。
1、同品種臨床評價實質(zhì):使用同品種產(chǎn)品的臨床數(shù)據(jù)開展申報產(chǎn)品的臨床評價(借用數(shù)據(jù)、實現(xiàn)數(shù)據(jù)外推來完成申報產(chǎn)品的臨床評價);
2、數(shù)據(jù)來源:臨床試驗數(shù)據(jù)、臨床經(jīng)驗數(shù)據(jù)、臨床文獻數(shù)據(jù);
3、同品種臨床數(shù)據(jù)的作用:
a. 確認同品種產(chǎn)品的安全有效性在現(xiàn)有認知下,是否已得到臨床公認,風險受益是否在可接受范圍內(nèi);
b. 充分識別同品種產(chǎn)品的臨床有效性和使用風險,為申報產(chǎn)品的風險受益分析提供信息;
c. 充分識別同品種產(chǎn)品的臨床風險,為風險管理(最小化臨床風險)提供信息;
d. 基于同品種產(chǎn)品進行設計變更的依據(jù);
e. 為部分非臨床研究(如臺架試驗)測試結(jié)果的評價提供臨床數(shù)據(jù)等。
當申報產(chǎn)品與同品種產(chǎn)品存在差異時,需提交充分的科學證據(jù)證明二者具有相同的安全有效性,從而論證其等同性。
1、增加具有可比性的同品種產(chǎn)品,提供臨床證據(jù);
2、非臨床研究(性能研究、臺架試驗、動物試驗);
3、申報產(chǎn)品的臨床證據(jù)。
醫(yī)療器械注冊咨詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295