文章出處:企業(yè)原創(chuàng) 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-02-29
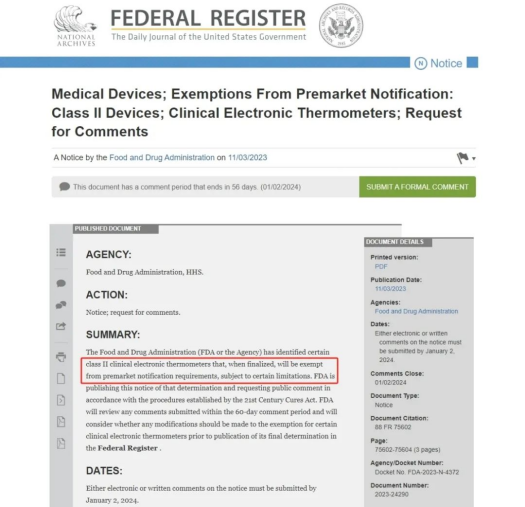
國內(nèi)電子體溫計制造商注意啦!
近日,美國聯(lián)邦公報發(fā)布一則征求意見稿,擬免除部分臨床電子體溫計(無遠程熱成像功能及連續(xù)測溫功能)的上市前通知要求,即我們常說的510(k)豁免。
這些擬被列入510(k)豁免名單的普通電子體溫計產(chǎn)品代碼為FLL,該公告同時指出,將為含遠程熱成像或連續(xù)測溫功能的電子體溫計創(chuàng)建新的產(chǎn)品代碼。
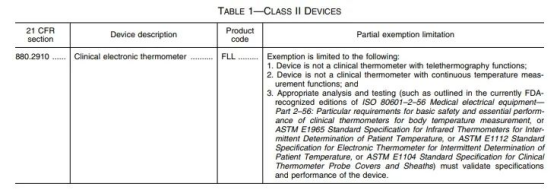
此份通知擬定了60天的意見征求時間,最終會在聯(lián)邦公報上正式公布。一旦正式生效,意味著普通電子體溫計只需進行注冊列名,即可進入美國市場進行銷售,與510(k)申請相比,整個流程就會簡單很多了。
以上就是本期分享內(nèi)容,金飛鷹在美國醫(yī)療器械注冊方面有著豐富案例,包括但不限于FDA 510(k)申請、產(chǎn)品列名、De Novo申請、QSR 820體系建立維護、FDA驗廠咨詢、美國UDI申請、鄧白氏碼申請、美國代理人服務(wù)等,假如您有醫(yī)療器械產(chǎn)品出口美國的需求,歡迎聯(lián)系我們咨詢~
醫(yī)療器械注冊咨詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295