文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時(shí)間:2024-02-26
作為發(fā)達(dá)國家中的一員,韓國的醫(yī)療器械市場規(guī)模是不可小覷的,然而與美國等其他發(fā)達(dá)國家相比,目前韓國醫(yī)療器械產(chǎn)業(yè)的國際競爭力仍處于較低水平,相關(guān)數(shù)據(jù)顯示,其國內(nèi)半數(shù)以上的獲準(zhǔn)醫(yī)療器械都源于韓國境外的國家。那么本期文章我們就來跟大家分享一下韓國醫(yī)療器械注冊的相關(guān)知識。 韓國根據(jù)產(chǎn)品對人體的潛在危害:1)與人體接觸的持續(xù)時(shí)間;2)侵入性程度;3)是否向患者提供藥品或能量;4)是否對患者有生物學(xué)影響,將醫(yī)療器械分為Ⅰ、Ⅱ、Ⅲ、Ⅳ四個(gè)風(fēng)險(xiǎn)等級。
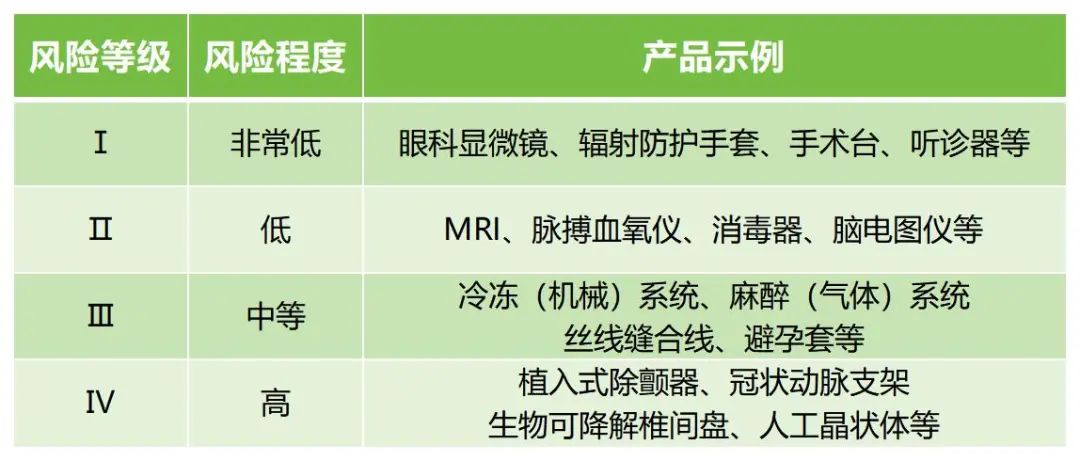
↑ 具體產(chǎn)品示例
1. 查閱Regulation on Medical Device Groups and Class by Group的Attachment,法規(guī)中規(guī)定了分類規(guī)則以及產(chǎn)品的代碼和風(fēng)險(xiǎn)等級,可以根據(jù)產(chǎn)品定義/用途等判斷產(chǎn)品的等級,我們隨附了示例圖,紅框的數(shù)字為產(chǎn)品的風(fēng)險(xiǎn)等級。 2. 在韓國已注冊產(chǎn)品的數(shù)據(jù)庫(可聯(lián)系我們獲取鏈接)中,用產(chǎn)品名稱(英文/韓文)進(jìn)行檢索,查找類似產(chǎn)品在MFDS中的分類。 上述方法需一并查詢以確定產(chǎn)品在韓國的分類。當(dāng)然,您也可以直接聯(lián)系我們幫您查詢~
在韓國,Ⅰ類產(chǎn)品一般只需在系統(tǒng)上做簡單的Notification登記即可,有SE Device(即實(shí)質(zhì)等同產(chǎn)品)的Ⅱ類產(chǎn)品,需遞交技術(shù)資料進(jìn)行NIDS認(rèn)證;而對于NSE Device(即沒有實(shí)質(zhì)等同產(chǎn)品)的Ⅱ類產(chǎn)品以及Ⅲ、Ⅳ類產(chǎn)品,則需要由MFDS批準(zhǔn)。不同類別產(chǎn)品所需提交的注冊資料不同,具體可聯(lián)系我們咨詢。
和大部分國家或地區(qū)一樣,在韓國沒有實(shí)體辦公場所的公司必須任命一名韓國許可持有人(Korean License Holder)來協(xié)調(diào)他們向MFDS注冊醫(yī)療器械的事務(wù)。KLH控制醫(yī)療器械注冊并幫助韓國境外制造商遵守韓國良好生產(chǎn)規(guī)范(KGMP)要求,并且其名字會出現(xiàn)在制造商的MFDS醫(yī)療器械注冊證書(產(chǎn)品審批證書)上。產(chǎn)品獲批后,KLH需負(fù)責(zé)進(jìn)口醫(yī)療器械的年度報(bào)告事宜,并且接受MFDS的突擊審核。
一般情況下,企業(yè)會選擇在韓國的分銷商作為證書持證人,但選擇沒有銷售合作并有能力協(xié)助產(chǎn)品注冊的韓國企業(yè)作為持證人,在后續(xù)需要更換經(jīng)銷商時(shí)可能會更加便捷。
在韓國,Ⅱ、Ⅲ、Ⅳ類醫(yī)療器械的制造商都需要符合KGMP(Korean Good Manufacturing Practice)的要求,KGMP要求與ISO 13485類似。
KGMP證書是頒發(fā)給進(jìn)口商(Importor)而不是制造商(Manufacturer), 證書每3年需更新一次,企業(yè)要在在證書過期前的90天更新。
通常對于高風(fēng)險(xiǎn)的Ⅲ、Ⅳ類醫(yī)療器械,由監(jiān)管當(dāng)局MFDS審核制造商的質(zhì)量管理體系,而Ⅱ類和部分Ⅲ、Ⅳ類的醫(yī)療器械交由第三方機(jī)構(gòu)審核。
審核現(xiàn)場的語言要求是韓語,因此企業(yè)需要提前準(zhǔn)備韓語翻譯。審核周期大約在9-12個(gè)月。
![]()
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295