文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2019-11-02
2017年5月5日歐盟正式發(fā)布了新版醫(yī)療器械法規(guī)MDR(EU 2017/745)。2017年5月25日,MDR正式生效。對于向歐盟銷售
醫(yī)療器械的制造商來說,這標(biāo)志著MDR過渡期已開始。醫(yī)療器械指令MDD(93/42/EEC)和有源植入醫(yī)療器械指令A(yù)IMDD
(90/385/EEC)被醫(yī)療器械法規(guī)MDR(EU 2017/745)取代,法規(guī)過渡期設(shè)為3年,2020年5月26號將強制執(zhí)行。
為了能幫助制造商在過渡期內(nèi)更好的制定CE認證計劃,我們?yōu)槟唵蔚厥崂砹薓DD到MDR過渡期的時間軸。
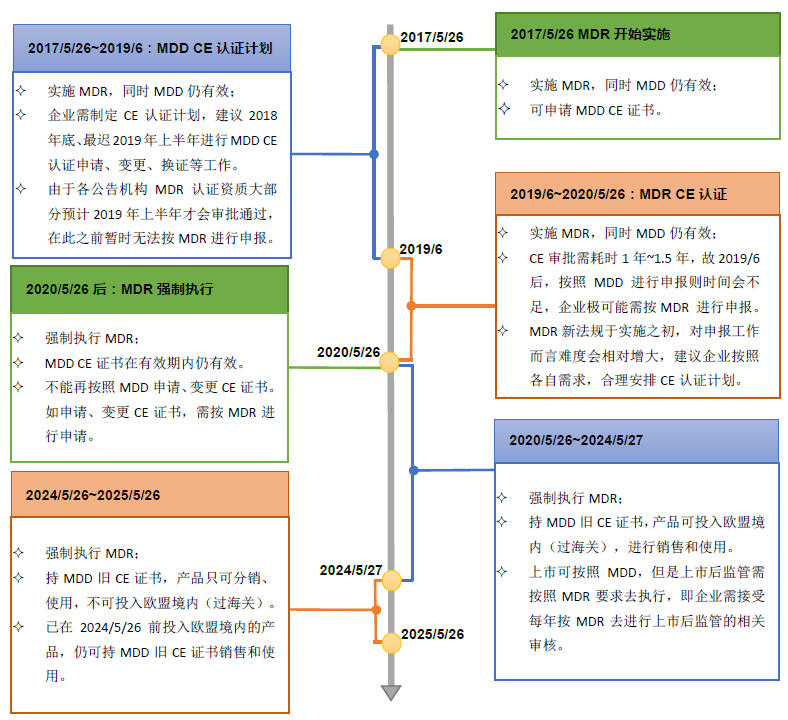
參考:MDR法規(guī)(EU 2017/745) Article 120 Transitional provisions
原創(chuàng):金飛鷹 - 陳騫
著作權(quán)聲明:本文由深圳市金飛鷹企業(yè)管理顧問有限公司編制,文中引用了政府的公開信息,轉(zhuǎn)載時請注明作者及出處。
更多內(nèi)容請關(guān)注金飛鷹公眾號,我們將為您推送更多更好的關(guān)于醫(yī)療器械行業(yè)解讀文章。您也可以在底部留言你所想要了解
的醫(yī)療器械問題,金飛鷹專業(yè)團隊將為您做針對性的原創(chuàng)解讀文章,以解君惑
