2月22日,中華人民共和國中央人民政府發(fā)布《國務院關于全面推進北京市服務業(yè)擴大開放綜合試點工作方案的批復》
(國函〔2019〕16號),規(guī)定北京將成為醫(yī)療器械注冊人制度試點,可委托京津冀地區(qū)醫(yī)療器械生產(chǎn)企業(yè)生產(chǎn)醫(yī)療器械。
讓我們看看注冊人制度有什么影響吧:
北京將成為注冊人制度試點
2月22日,中華人民共和國中央人民政府發(fā)布《國務院關于全面推進北京市服務業(yè)擴大開放綜合試點工作方案的批復》
(國函〔2019〕16號)第5條規(guī)定:“開展醫(yī)療器械注冊人制度試點,允許北京市醫(yī)療器械注冊人委托京津冀地區(qū)醫(yī)療器械生產(chǎn)
企業(yè)生產(chǎn)醫(yī)療器械,助推“注冊+生產(chǎn)”跨區(qū)域產(chǎn)業(yè)鏈發(fā)展。”
已經(jīng)實施注冊人制度的地區(qū)
上海市
2018年1月10日,原國家食品藥品監(jiān)督管理總局發(fā)布《總局關于上海市食品藥品監(jiān)督管理局開展醫(yī)療器械注冊人制度試點工作的
公告》(2018年第1號)文件,標志著上海市成為國內(nèi)首個注冊人制度試點,2月27日上海遠心醫(yī)療科技有限公司的單道心電記
錄儀,獲得由上海食藥監(jiān)局頒發(fā)注冊人制度施行后的首張第二類醫(yī)療器械產(chǎn)品注冊證。
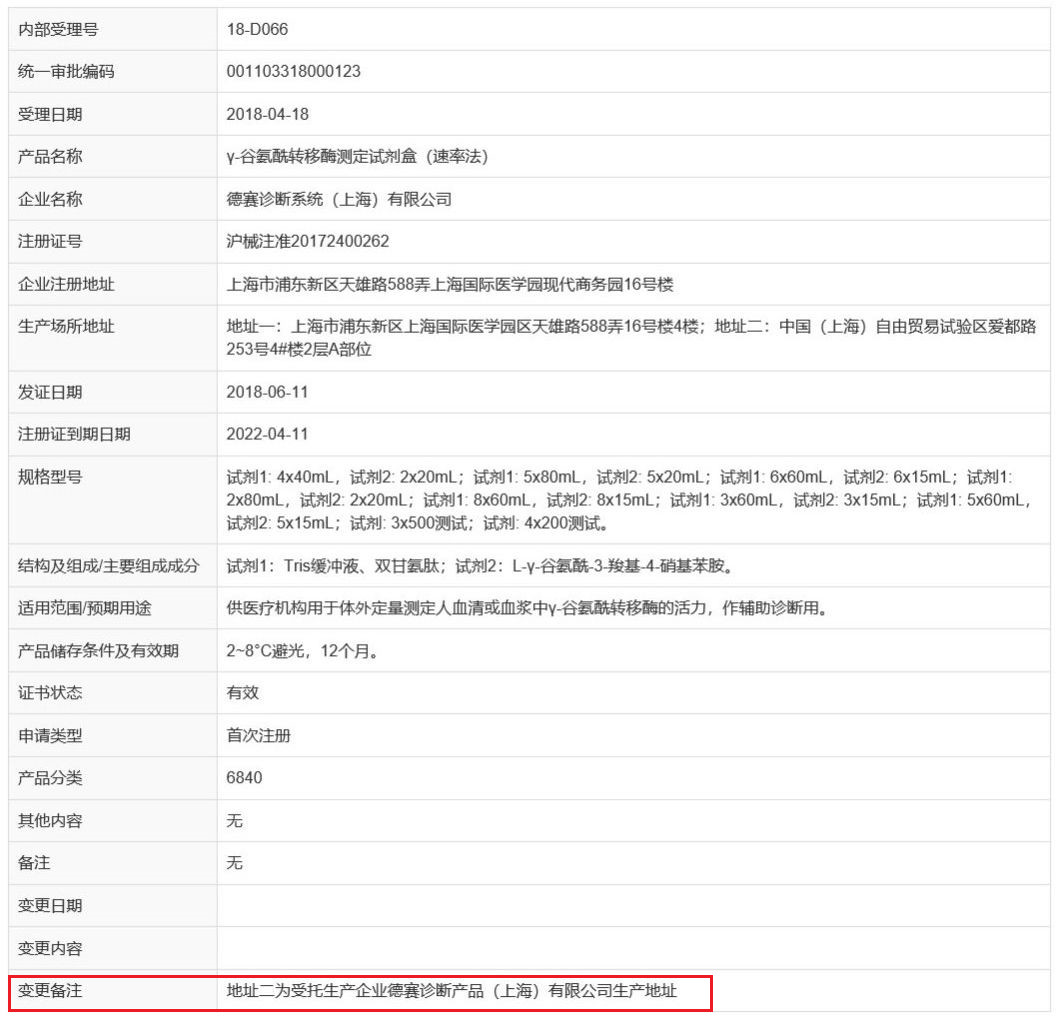
上海后續(xù)公示的獲批企業(yè)中,陸續(xù)有企業(yè)獲得醫(yī)療器械注冊證,這些企業(yè)都已經(jīng)公示了委托生產(chǎn)企業(yè),展示在備注或變更備注
欄中,詳情如下圖所示~
廣東省
2018年8月16日,國家藥品監(jiān)督管理局發(fā)布《國家藥品監(jiān)督管理局關于同意開展醫(yī)療器械注冊人制度試點工作的批復》
(國藥監(jiān)函[2018]42號)文件,標志著廣東成為第2個試點。9月29日,廣東食品藥品監(jiān)督管理局為深圳邁瑞科技有限公司頒發(fā)
廣東省醫(yī)療器械注冊人制度施行后的首張第二類醫(yī)療器械產(chǎn)品注冊證。
天津市
2018年8月16日,國家藥品監(jiān)督管理局發(fā)布《國家藥品監(jiān)督管理局關于同意開展醫(yī)療器械注冊人制度試點工作的批復》
(國藥監(jiān)函[2018]43號)文件,自此天津市成為國內(nèi)第3個注冊人制度試點。
注冊人制度帶來的主要變化
主要改革
中國醫(yī)療器械監(jiān)管現(xiàn)行政策實行產(chǎn)品注冊和生產(chǎn)許可“捆綁”的模式,醫(yī)療器械產(chǎn)品上市必須由自己研發(fā)自己生產(chǎn),委托生產(chǎn)
只允許雙方同時具備醫(yī)療器械注冊證和生產(chǎn)許可證的企業(yè)才可以申請辦理。

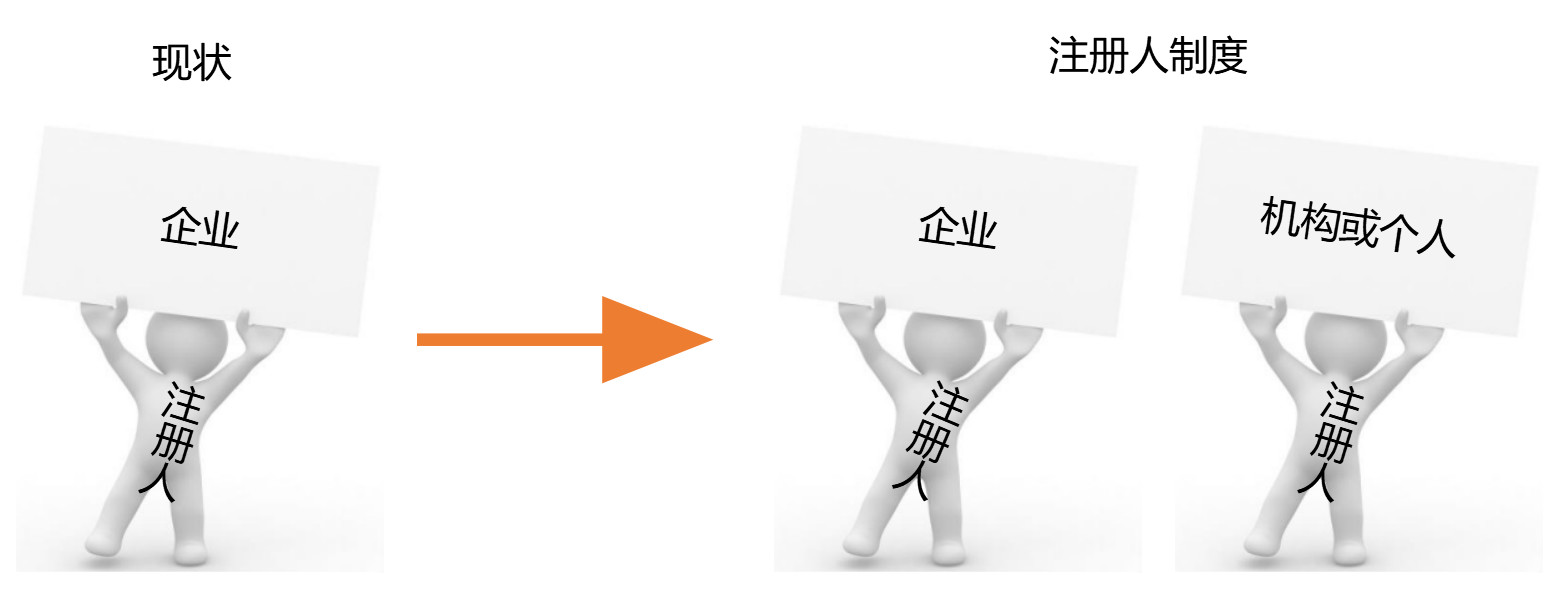
實施注冊人制度將為產(chǎn)品注冊和生產(chǎn)許可“解綁”,如下圖所示:

注冊申請人取得醫(yī)療器械注冊證后,成為注冊人。醫(yī)療器械注冊人對全生命周期產(chǎn)品質(zhì)量承擔全部責任。
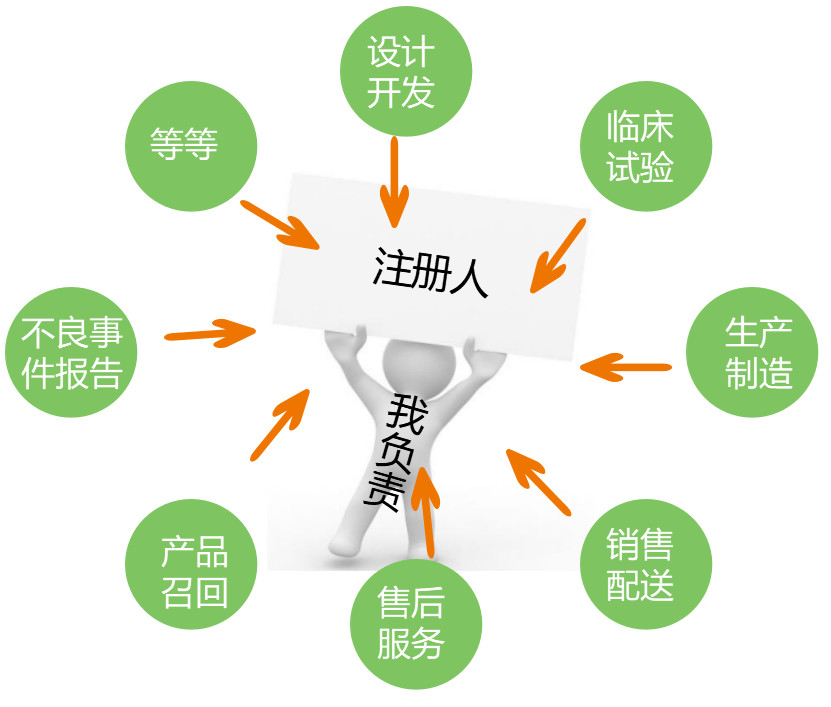
將技術交付給受托人之后,不能不聞不問。必須要起到監(jiān)督審查的責任,避免產(chǎn)品在生產(chǎn)環(huán)節(jié)出錯。確保對上市醫(yī)療器械進行持
續(xù)研究,及時報告不良事件及其風險評估情況,提出并落實處置措施。
受托人應履行《醫(yī)療器械監(jiān)督管理條例》及其他相關法律法規(guī)以及委托合同、質(zhì)量協(xié)議規(guī)定的義務,并承擔相應的法律責任。
對有問題的產(chǎn)品需要及時對產(chǎn)品進行召回,并告知注冊人和監(jiān)管機關。
接受注冊人監(jiān)督,確保醫(yī)療器械符合國家質(zhì)量標準。
主要改革措施:一是醫(yī)療器械注冊申請人可委托試點內(nèi)具備相應生產(chǎn)條件的企業(yè)(即受托企業(yè))生產(chǎn)樣品。突破了現(xiàn)行法規(guī)只有
原國家食品藥品監(jiān)督管理總局認定的創(chuàng)新醫(yī)療器械產(chǎn)品樣品才可以委托生產(chǎn)的規(guī)定;

二是注冊人除可自行生產(chǎn)外,還可以委托生產(chǎn),且可以同時委托多家企業(yè)生產(chǎn)。
此次改革主要為了鼓勵注冊人專注于提高產(chǎn)品研發(fā)和技術更新能力,如果本身不具備生產(chǎn)力,可以委托給試點內(nèi)符合資質(zhì)的企業(yè)
進行生產(chǎn),這是對我國醫(yī)療器械行業(yè)的一次重大變革。
值得注意的是:注冊人需要具備承擔醫(yī)療器械質(zhì)量安全責任的能力,不僅可以是企業(yè),也可以是機構(gòu)和個人。
審批周期
上海遠心醫(yī)療科技有限公司,是自實施注冊人制度以來首個獲批注冊人證書的企業(yè)。其產(chǎn)品從正式受理至準予上市僅用時26個
工作日,國產(chǎn)二類醫(yī)療器械正常審批需要158個工作日,5個工作日受理,整整縮短了82%。
周期的縮短有利于節(jié)省企業(yè)成本,我國醫(yī)療器械產(chǎn)業(yè)高速發(fā)展后,產(chǎn)能過剩逐漸成為顯著問題,越早通過注冊,也可以越早的
投入生產(chǎn)。
你的企業(yè)所在地有沒有施行注冊人制度?我們也會繼續(xù)關注其他省市實施注冊人制度的情況,會在第一時間反饋給大家。