此前我們給大家整理了新加坡、日本、沙特、泰國、韓國、巴西等境外注冊系列文章(戳此回顧→境外注冊),那么今天再帶大家了解一下保留了醫(yī)療器械監(jiān)管權的香港:誠然,香港擁有極為發(fā)達的醫(yī)療體系,但其自身并沒有大規(guī)模的醫(yī)療器械制造業(yè),主要依賴進口來滿足市場需求。因此,香港地區(qū)也是國內企業(yè)可以重點關注的市場。

方法一:查閱《TR-003普通醫(yī)療器械分類》的分類規(guī)則,依據(jù)分類規(guī)則判斷產品風險等級;
方法二:利用官網(wǎng)上的風險等級決策小工具進行判斷;
方法三:利用香港醫(yī)療器械表列數(shù)據(jù)庫查詢同類產品的風險等級。
方法二、三涉及到的具體網(wǎng)址,可添加文末小編微信獲取。
在確認好產品分類后,香港境外企業(yè)需要做的第一件事是指定一個香港本地負責人LRP。接著可在香港本地對產品進行認證評審或提供指定國家或地區(qū)的銷售授權證明,準備好醫(yī)療器械行政控制系統(tǒng)MDACS要求的注冊申請相關文件后,由LRP向醫(yī)療器械科MDD提交申請,一旦獲得批準,該醫(yī)療器械將被簽發(fā)一個香港醫(yī)療器械編號,并列入醫(yī)療器械科MDD數(shù)據(jù)庫。
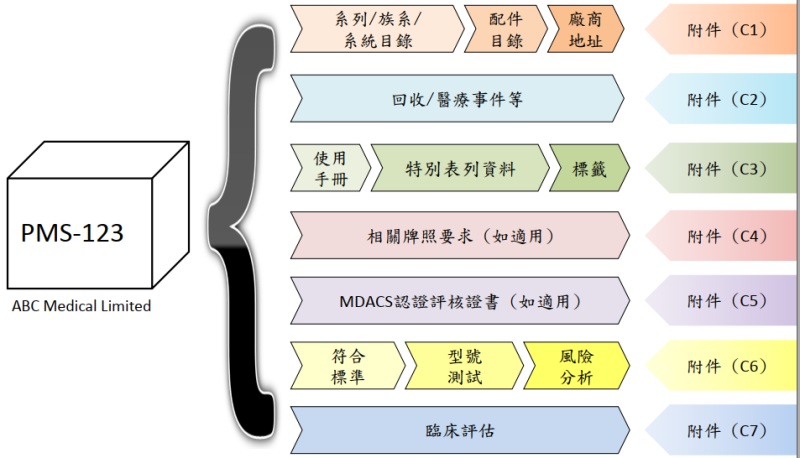
注意事項:在醫(yī)療器械科MDD數(shù)據(jù)庫中,批準有效期為5年。表列證書由LPR持有,LRP必須在醫(yī)療器械行政控制系統(tǒng)MDACS表列到期前至少3個月提交更新申請。
另根據(jù)MDD發(fā)布的最新指南文件GN-04:2024(C),除接受香港認可的認證評核機構(如TUV、SGS、BSI)對產品進行的認證審核外,制造商還可用替代途徑,即出示醫(yī)療器械獲準在GHTF一個或以上創(chuàng)始成員國(即澳洲、加拿大、歐盟、日本及美國)銷售;或提供醫(yī)療器械在中國內地、韓國及/或新加坡的銷售批核文件,借此證明儀器符合指南第GN-01號所明確的醫(yī)療器械安全及性能基本原則。
香港本地負責人(Local Responsible Person,簡稱“LPR”)必須是香港成立法團的法人,或在香港設有注冊營業(yè)地址的自然人或法人。LPR是醫(yī)療器械制造商的授權代表,也是將醫(yī)療器械推出市面的負責人。

LPR有以下職責和作用:
1. 在使用者、進口商、分銷商、公眾及政府之間作為有效的溝通渠道;
2. 負責協(xié)助制造商進行表列申請,備份儲存醫(yī)療器械的相關文件資料;
3. 接受及處理顧客投訴,需應要求為使用者提供或安排他人提供預防性及故障維修服務;
4. 需設有追蹤制度,符合條件的產品追蹤至病人層面;
5. 呈報及調查醫(yī)療事件,以及展開及管理任何糾正預防措施等;
6. 履行醫(yī)療器械與廣告宣傳有關的責任等。
以上就是我們本期分享的香港醫(yī)療器械注冊的基本知識點,假如您有醫(yī)療器械境外(包括但不限于美國、歐盟、澳大利亞、加拿大、新加坡、日本、沙特、巴西等)注冊需求,歡迎聯(lián)系我們咨詢!
醫(yī)療器械注冊咨詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052