文章出處:公告通知 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-05-09
美國食品和藥物管理局(FDA)在2024年4月針對中國制造的塑料注射器發(fā)布了一系列警告和行動,主要關(guān)注未經(jīng)授權(quán)或不符合FDA標(biāo)準(zhǔn)的注射器在美國的銷售和分銷。以下是針對這些信息的摘要和建議的總結(jié):
違規(guī)行為和警告信:
FDA向多個涉及中國制造的塑料注射器銷售和分銷的實體發(fā)出了警告信,包括Cardinal Health、Medline Industries, LP和Sol-Millennium Medical, Inc.,指出他們存在分銷和銷售不符合注射器產(chǎn)品質(zhì)量體系法規(guī)相關(guān)產(chǎn)品的違規(guī)行為。
特定制造商的問題:

FDA特別關(guān)注了江蘇神力醫(yī)療生產(chǎn)有限公司和江蘇采納醫(yī)療有限公司生產(chǎn)的塑料注射器,因為它們存在質(zhì)量問題或與FDA標(biāo)準(zhǔn)不符。FDA建議供應(yīng)商、消費者、醫(yī)療保健提供者和機構(gòu)在過渡期間避免使用這些特定制造商的產(chǎn)品,除非絕對必要。
在FDA一系列警告下,采納股份發(fā)布公告稱,公司關(guān)注到美國食藥監(jiān)局官網(wǎng)發(fā)布的關(guān)于醫(yī)療器械的安全通訊,該通訊涉及對公司全資子公司采納醫(yī)療出具進口警示。4月8早盤,采納股份20%跌停。工作人員回應(yīng)稱,本次警示涉及的為注射器類產(chǎn)品,該警示對公司影響較大,意味著公司相關(guān)產(chǎn)品在美國海關(guān)處無需檢查即可進行扣留。目前公司正在積極與FDA方面進行溝通。
對所有中國制造的塑料注射器的建議:
盡管FDA對特定制造商的評估仍在進行中,但FDA建議供應(yīng)商、消費者、醫(yī)療保健提供者和機構(gòu)采取以下措施:
一、檢查注射器的制造地點,避免使用中國制造的注射器(不包括玻璃注射器、預(yù)充式注射器或用于口服或局部目的的注射器)。
二、如果只有中國制造的注射器可用,應(yīng)繼續(xù)使用并密切監(jiān)測其性能,如泄漏、破損等問題。
三、向FDA報告任何與注射器相關(guān)的問題。
FDA的后續(xù)行動:
FDA表示將繼續(xù)努力評估中國制造的塑料注射器的問題,包括進行設(shè)施檢查、邊境檢查、實驗室測試和與制造商合作以確保采取適當(dāng)?shù)募m正措施。并且承諾隨著新信息或額外信息的出現(xiàn),將繼續(xù)向公眾通報情況。
海外第一大市場
自去年11月起,美國食品和藥物管理局(FDA)就已開始評估并調(diào)查中國生產(chǎn)的塑料注射器,特別是針對在美國境內(nèi)營銷和分銷的產(chǎn)品。并對邊境的產(chǎn)品進行了檢查扣留和實驗室測試。經(jīng)過評估證實,中國制造的塑料注射器的質(zhì)量問題及其在美國的分銷問題比最初已知的更為普遍。
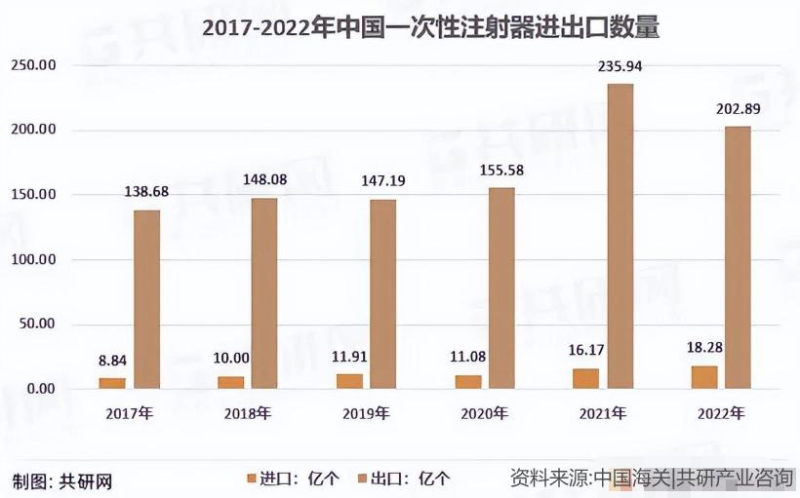
中國作為一次性注射器的生產(chǎn)大國和出口大國,其年出口數(shù)量在近年來有顯著增長。據(jù)共研網(wǎng)統(tǒng)計,2017-2022年期間,我國一次性注射器年出口數(shù)量從138.68億個增加到202.89億個。如果FDA全面禁止中國塑料注射器進入美國,無疑將給我國注射器出口帶來重大影響。
然而,目前FDA并沒有全面禁止中國塑料注射器進入美國,而是采取了一系列措施來確保產(chǎn)品的質(zhì)量和安全。這包括加強對邊境產(chǎn)品的檢查扣留和實驗室測試,以及向相關(guān)公司發(fā)出警告信并要求其解決違規(guī)行為。
因此,對于中國的注射器制造商來說,他們應(yīng)該密切關(guān)注FDA的最新動態(tài)和要求,并加強自身的產(chǎn)品質(zhì)量管理和控制,以確保產(chǎn)品符合FDA的標(biāo)準(zhǔn)和要求。同時,他們也應(yīng)該積極與FDA合作,共同解決存在的問題,以維護中國注射器在全球市場的聲譽和地位。
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052