文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時(shí)間:2024-03-07
眾所周知,開(kāi)展藥物臨床試驗(yàn)必須提供臨床試驗(yàn)用藥物的藥檢報(bào)告;同樣,醫(yī)療器械臨床試驗(yàn)中產(chǎn)品檢驗(yàn)報(bào)告也是不可或缺的。只有檢驗(yàn)合格,方可開(kāi)展臨床試驗(yàn)或者申請(qǐng)注冊(cè)、進(jìn)行備案。而產(chǎn)品檢驗(yàn)報(bào)告除了規(guī)定的注冊(cè)檢驗(yàn)外,還常見(jiàn)委托檢驗(yàn)、自檢報(bào)告等多種形式。
這些不同類(lèi)型的檢驗(yàn)報(bào)告各代表什么意思?分別適用何種情況?都有什么區(qū)別呢?
為貫徹落實(shí)鼓勵(lì)醫(yī)療器械產(chǎn)業(yè)創(chuàng)新發(fā)展的要求,進(jìn)一步深化“放管服”改革,新版《醫(yī)療器械注冊(cè)與備案管理辦法》(2021年8月26日公布)明確提出,醫(yī)療器械產(chǎn)品檢驗(yàn)報(bào)告可以是醫(yī)療器械注冊(cè)申請(qǐng)人、備案人的自檢報(bào)告,也可以是委托有資質(zhì)的醫(yī)療器械檢驗(yàn)機(jī)構(gòu)出具的檢驗(yàn)報(bào)告。這是醫(yī)療器械注冊(cè)工作要求的重大調(diào)整,以前的注冊(cè)檢驗(yàn),現(xiàn)在委托檢驗(yàn)和注冊(cè)自檢均給予認(rèn)可。
下面我們?cè)敿?xì)介紹下三種類(lèi)型產(chǎn)品檢驗(yàn)報(bào)告。
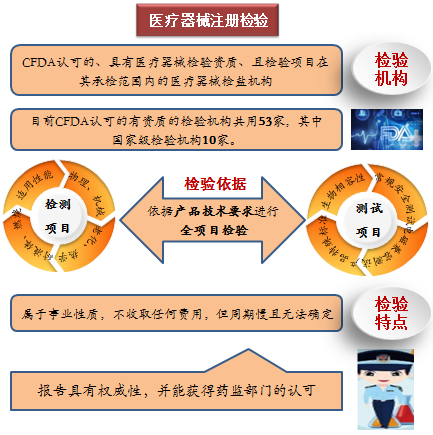
注冊(cè)檢驗(yàn)是指國(guó)家藥品監(jiān)督管理局認(rèn)可的、具有醫(yī)療器械檢驗(yàn)資質(zhì)、且檢驗(yàn)項(xiàng)目在其承檢范圍內(nèi)的醫(yī)療器械檢測(cè)機(jī)構(gòu),依據(jù)產(chǎn)品技術(shù)要求對(duì)申報(bào)產(chǎn)品進(jìn)行全項(xiàng)目檢驗(yàn),并出具檢驗(yàn)報(bào)告。
目前國(guó)家藥監(jiān)局認(rèn)可的有資質(zhì)的檢驗(yàn)機(jī)構(gòu)共有53家,其中國(guó)家級(jí)檢驗(yàn)機(jī)構(gòu)10家。注冊(cè)檢驗(yàn)屬事業(yè)性質(zhì),不收取任何費(fèi)用,但需排隊(duì)候檢,周期慢且無(wú)法確定,依據(jù)檢測(cè)機(jī)構(gòu)目前承接項(xiàng)目預(yù)計(jì)周期。其報(bào)告具有權(quán)威性,并能獲得藥監(jiān)部門(mén)的認(rèn)可。隨著新版《醫(yī)療器械注冊(cè)與備案管理辦法》的實(shí)施,以前針對(duì)第二、三類(lèi)醫(yī)療器械注冊(cè)檢驗(yàn)的概念越來(lái)越淡化,委托檢驗(yàn)和企業(yè)自檢逐漸走進(jìn)行業(yè)舞臺(tái)。
委托檢驗(yàn)是企業(yè)委托藥監(jiān)認(rèn)可的檢測(cè)機(jī)構(gòu)或者第三方檢測(cè)機(jī)構(gòu),依據(jù)標(biāo)準(zhǔn)和產(chǎn)品技術(shù)要求對(duì)產(chǎn)品安全性有效性做出技術(shù)評(píng)價(jià),并取得檢驗(yàn)報(bào)告的過(guò)程。委托檢驗(yàn)具備商業(yè)性質(zhì),收取加速檢測(cè)的費(fèi)用,周期相對(duì)普通的注冊(cè)檢驗(yàn)較快。委托的檢驗(yàn)機(jī)構(gòu)不限于藥監(jiān)系統(tǒng),第三方有檢驗(yàn)檢測(cè)機(jī)構(gòu)資質(zhì)認(rèn)定證書(shū)及CMA資質(zhì),且承檢范圍內(nèi)有對(duì)應(yīng)標(biāo)準(zhǔn)的都可以。

但第三方機(jī)構(gòu)是否有能力真正比肩藥監(jiān)系統(tǒng)下醫(yī)療器械專(zhuān)業(yè)檢測(cè)機(jī)構(gòu)所執(zhí)行的檢驗(yàn)檢測(cè)程序仍是一個(gè)重大挑戰(zhàn),目前第三方出具的檢測(cè)報(bào)告可能不被認(rèn)可。
注冊(cè)自檢是醫(yī)療器械注冊(cè)申請(qǐng)人按照產(chǎn)品技術(shù)要求,自行對(duì)其申報(bào)的產(chǎn)品進(jìn)行全項(xiàng)目檢驗(yàn),并出具自檢報(bào)告。注冊(cè)申請(qǐng)人開(kāi)展自檢工作,包括自己公司檢測(cè)、委托受托生產(chǎn)企業(yè)檢測(cè),這些都不需要任何資質(zhì),但應(yīng)具有產(chǎn)品技術(shù)要求中相應(yīng)的自行檢驗(yàn)?zāi)芰Γň邆湎鄳?yīng)人員、設(shè)備、設(shè)施和環(huán)境等,并按照質(zhì)量管理體系要求開(kāi)展檢驗(yàn)。自檢工作將會(huì)納入醫(yī)療器械質(zhì)量管理體系核查中。
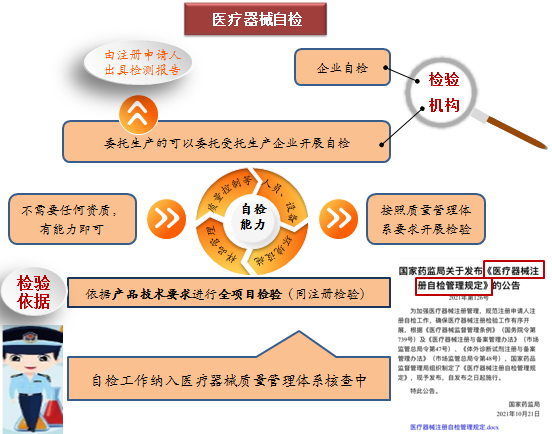
為規(guī)范自檢程序,2021年10月21日國(guó)家藥品監(jiān)督管理局印發(fā)了《關(guān)于醫(yī)療器械注冊(cè)自檢管理規(guī)定》(國(guó)家藥品監(jiān)督管理局公告第126號(hào))。自檢不是放松要求,而是意味著企業(yè)將承擔(dān)更多的主體責(zé)任,是落實(shí)注冊(cè)人為第一責(zé)任人的一個(gè)具體表現(xiàn)。
新版《醫(yī)療器械注冊(cè)與備案管理辦法》的發(fā)布,明確了除注冊(cè)檢驗(yàn)外,委托檢驗(yàn)和注冊(cè)自檢等多種類(lèi)型的檢驗(yàn)報(bào)告均給予認(rèn)可。對(duì)于企業(yè)來(lái)說(shuō),在醫(yī)療器械注冊(cè)工作中有了更多的選擇空間,
信息來(lái)源:浙大一院臨床試驗(yàn)
排版整理:金飛鷹藥械
醫(yī)療器械注冊(cè)咨詢(xún)認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295