文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-03-04
在醫(yī)療器械設(shè)計開發(fā)過程中,設(shè)計確認(rèn)是其重要環(huán)節(jié),以確保產(chǎn)品能夠滿足規(guī)定的使用要求或者預(yù)期用途的要求。可采取多種方法實現(xiàn)設(shè)計確認(rèn),如模體試驗、計算機模擬試驗、動物試驗、臨床評價等。那么,醫(yī)療器械產(chǎn)品注冊在哪些情況下需開展臨床試驗?zāi)兀?/strong>
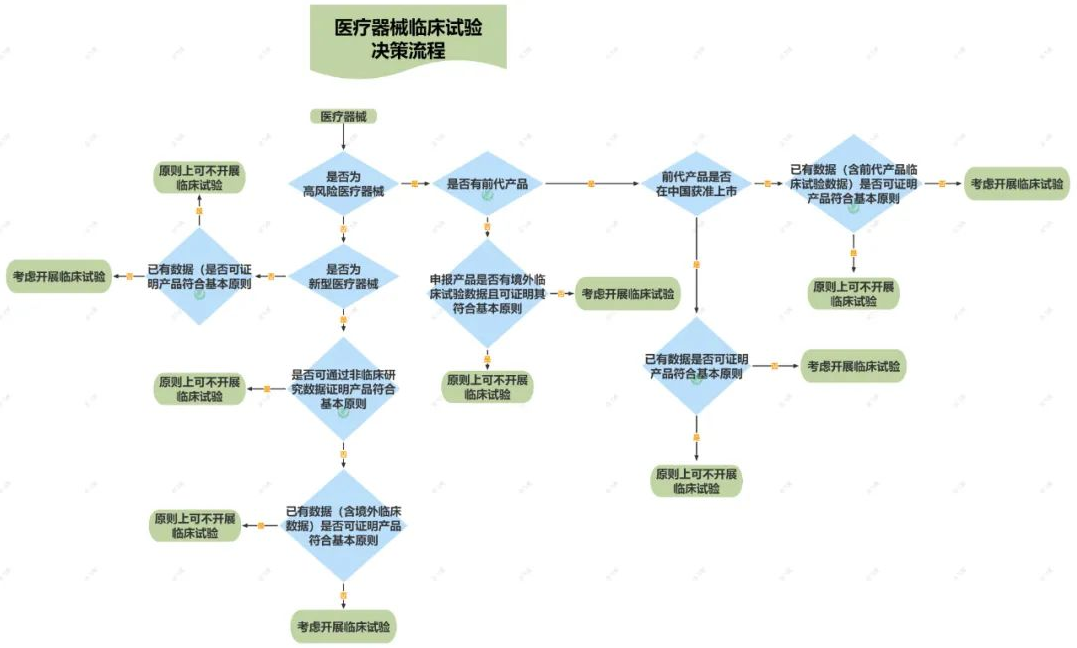
臨床使用具有高風(fēng)險的第三類醫(yī)療器械(以下簡稱“高風(fēng)險醫(yī)療器械”),原則上需要開展臨床試驗,但以下情形可考慮免于開展臨床試驗:
1.申報產(chǎn)品的前代產(chǎn)品未在中國獲準(zhǔn)上市,申報產(chǎn)品是對前代產(chǎn)品進行的設(shè)計變更,注冊申請人可通過已有數(shù)據(jù)(如非臨床研究數(shù)據(jù)、前代產(chǎn)品的臨床試驗數(shù)據(jù)、申報產(chǎn)品境外臨床數(shù)據(jù))證明申報產(chǎn)品符合醫(yī)療器械安全和性能基本原則。
2.注冊申請人可按照《接受醫(yī)療器械境外臨床試驗數(shù)據(jù)技術(shù)指導(dǎo)原則》的要求提供申報產(chǎn)品境外臨床試驗數(shù)據(jù),結(jié)合其他設(shè)計驗證和確認(rèn)文件、器械描述、說明書和標(biāo)簽、風(fēng)險管理文件以及生產(chǎn)信息進行綜合評價,證明申報產(chǎn)品符合醫(yī)療器械安全和性能的基本原則。
3.申報產(chǎn)品的前代產(chǎn)品已在中國獲準(zhǔn)上市,申報產(chǎn)品是對前代產(chǎn)品進行的設(shè)計變更,且注冊申請人可通過已有數(shù)據(jù)(如非臨床研究數(shù)據(jù)、前代產(chǎn)品的臨床數(shù)據(jù)、申報產(chǎn)品境外臨床數(shù)據(jù))證明申報產(chǎn)品符合醫(yī)療器械安全和性能基本原則。
前代產(chǎn)品是指與申報產(chǎn)品屬于同一注冊申請人、具有相同適用范圍且技術(shù)特征和生物學(xué)特性相似的產(chǎn)品,申報產(chǎn)品與前代產(chǎn)品為迭代關(guān)系。
申報產(chǎn)品雖然不屬于高風(fēng)險醫(yī)療器械,但為新型醫(yī)療器械,原則上應(yīng)開展臨床試驗,但以下情形可考慮免于開展臨床試驗:
1.注冊申請人可通過非臨床研究數(shù)據(jù)充分證明申報產(chǎn)品符合醫(yī)療器械安全和性能基本原則。
2.申報產(chǎn)品在我國為新型醫(yī)療器械,但其自身已有臨床數(shù)據(jù)(例如境外臨床文獻(xiàn)數(shù)據(jù)、境外臨床試驗數(shù)據(jù)等),注冊申請人可通過非臨床研究數(shù)據(jù)、申報產(chǎn)品的臨床數(shù)據(jù)證明申報產(chǎn)品符合醫(yī)療器械安全和性能基本原則。
3.申報產(chǎn)品在我國為新型醫(yī)療器械,但其前代產(chǎn)品已有境外臨床數(shù)據(jù),申報產(chǎn)品是對前代產(chǎn)品進行的設(shè)計變更,注冊申請人可通過非臨床研究數(shù)據(jù)、申報產(chǎn)品的境外臨床數(shù)據(jù)和前代產(chǎn)品的境外臨床數(shù)據(jù)充分證明申報產(chǎn)品符合醫(yī)療器械安全和性能基本原則。
新型醫(yī)療器械是指與已在中國境內(nèi)獲準(zhǔn)上市的醫(yī)療器械相比,在適用范圍、技術(shù)特征和/或生物學(xué)特性等方面具有顯著差異的醫(yī)療器械。大部分醫(yī)療器械是一個漸進的變更過程,并不屬于新型醫(yī)療器械,很多情形下,可以通過非臨床研究來證明其符合醫(yī)療器械安全和性能的基本原則。
產(chǎn)品不屬于高風(fēng)險醫(yī)療器械,也不屬于新型醫(yī)療器械,在注冊申請人已開展充分的非臨床研究且全面收集已有臨床數(shù)據(jù)的基礎(chǔ)上,若已有證據(jù)不能證明產(chǎn)品符合醫(yī)療器械安全和性能的基本原則時,有可能需要通過開展臨床試驗補充臨床數(shù)據(jù)。獲得的臨床試驗數(shù)據(jù)用于產(chǎn)品臨床評價過程且為臨床證據(jù)的一部分。
例如,對于特定申報產(chǎn)品,其已有同品種產(chǎn)品在中國獲準(zhǔn)注冊,申報產(chǎn)品與同品種產(chǎn)品存在差異。若注冊申請人基于申報產(chǎn)品的非臨床研究數(shù)據(jù)以及同品種產(chǎn)品的臨床數(shù)據(jù)對產(chǎn)品實施了全面的臨床評價,但仍不能證明申報產(chǎn)品符合醫(yī)療器械安全和性能的基本原則,則可能需要開展臨床試驗。
以下為醫(yī)療器械臨床試驗決策流程圖,大家可保存?zhèn)溆茫?/span>
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295