今年7月,國家藥監(jiān)局更新了《免于進行臨床評價醫(yī)療器械目錄(2023年)》,那么對于這些被列入免于臨床評價目錄的醫(yī)械產(chǎn)品,應(yīng)提交哪些評價資料呢?
依據(jù)《列入免于臨床評價醫(yī)療器械目錄產(chǎn)品對比說明技術(shù)指導(dǎo)原則》,對于列入《免于進行臨床評價醫(yī)療器械目錄》(以下簡稱《目錄》)產(chǎn)品,注冊申請人需提交申報產(chǎn)品相關(guān)信息與《目錄》所述內(nèi)容的對比資料和申報產(chǎn)品與已獲準境內(nèi)注冊的《目錄》中醫(yī)療器械的對比說明。具體需提交的資料要求如下:
(一)提交申報產(chǎn)品相關(guān)信息與《目錄》所述內(nèi)容的對比資料;
(二)提交申報產(chǎn)品與《目錄》中已獲準境內(nèi)注冊醫(yī)療器械的對比說明,對比說明應(yīng)當包括《申報產(chǎn)品與目錄中已獲準境內(nèi)注冊醫(yī)療器械對比表》和相應(yīng)支持性資料。若經(jīng)對比,申報產(chǎn)品與對比產(chǎn)品存在差異,還應(yīng)提交差異部分對安全有效性影響的分析研究資料。二者的差異不應(yīng)引起不同的安全有效性問題,即申報產(chǎn)品未出現(xiàn)對比產(chǎn)品不存在的且可能引發(fā)重大風險和/或引起顯著影響有效性的問題。
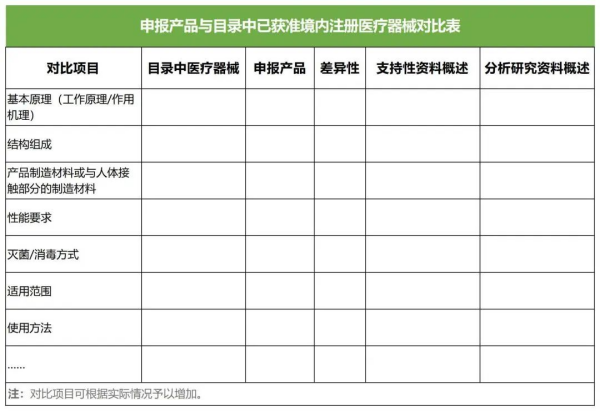
提交的上述資料應(yīng)能證明申報產(chǎn)品與《目錄》所述的產(chǎn)品具有基本等同性。若無法證明申報產(chǎn)品與《目錄》所述的產(chǎn)品具有基本等同性,則應(yīng)開展臨床評價。
醫(yī)療器械注冊咨詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295