文章出處:公告通知 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-02-28

12月11日,國家藥監(jiān)局器審中心發(fā)布《面部注射填充材料臨床試驗注冊審查指導(dǎo)原則(征求意見稿)》《體外膜肺氧合系統(tǒng)臨床評價注冊審查指導(dǎo)原則(征求意見稿)》等4項醫(yī)療器械注冊審查指導(dǎo)原則,并向社會公開征求意見。
意見反饋時間:2024年1月2日前
我們將《面部注射填充材料臨床試驗注冊審查指導(dǎo)原則》部分重點內(nèi)容摘錄如下:
本指導(dǎo)原則適用于整形用面部注射填充物,預(yù)期注射到真皮層和/或皮下組織、骨膜上層以填充增加組織容積,具體包括以下產(chǎn)品:
用于糾正鼻唇溝皺紋(真皮中層及深層、皮下組織淺層)、改善外鼻體積及形態(tài)(骨膜上層)、矯正中面部容量缺失和/或中面部輪廓缺陷(皮下組織和/或骨膜上層)、矯正唇部不對稱或輪廓畸形及唇部容積缺損等結(jié)構(gòu)缺陷(唇紅體和唇紅緣的唇粘膜下層、真皮淺層或中層)、改善輕度至中度下頜后縮患者下頜輪廓(骨膜上層)的注射用透明質(zhì)酸鈉凝膠(包括經(jīng)化學(xué)交聯(lián),不包括復(fù)合溶液);
用于糾正鼻唇溝皺紋(真皮組織)、糾正額部動力性皺紋(真皮組織)的動物源膠原蛋白產(chǎn)品、用于糾正額部動力性皺紋(真皮組織)的重組Ⅲ型人源化膠原蛋白產(chǎn)品;
用于改善外鼻體積及形態(tài)(骨膜上層)的整形用膠原和聚甲基丙烯酸甲酯皮下植入物系統(tǒng);
用于糾正鼻唇溝皺紋(真皮深層)的聚左旋乳酸面部填充劑、用于糾正鼻唇溝皺紋(皮下組織)的聚己內(nèi)酯面部填充劑。
按現(xiàn)行《醫(yī)療器械分類目錄》,該類產(chǎn)品分類編碼為13-09-02,管理類別為Ⅲ類。
若申請人提交境外臨床試驗數(shù)據(jù),需符合《接受醫(yī)療器械境外臨床試驗數(shù)據(jù)技術(shù)指導(dǎo)原則》的要求,例如考慮到與中國人群皮膚特征的相似度,境外臨床試驗需基于東亞人群開展,且符合本指導(dǎo)原則要求。
以申請首次注冊上市為目的的該類產(chǎn)品臨床試驗需是前瞻性、隨機(jī)對照臨床試驗。根據(jù)設(shè)計預(yù)期的臨床意義及試驗醫(yī)療器械的性能選擇合適的試驗類型(優(yōu)效/等效/非劣效)。對于同一產(chǎn)品具有多個適應(yīng)證時,建議針對不同適應(yīng)證分別進(jìn)行臨床試驗設(shè)計。
建議采用適用范圍相同的已上市同類產(chǎn)品作為對照醫(yī)療器械,優(yōu)先選擇與試驗醫(yī)療器械組成成分、產(chǎn)品性能相似的產(chǎn)品作為對照醫(yī)療器械。如選擇空白對照,需重點考慮臨床試驗的倫理性;試驗應(yīng)為優(yōu)效設(shè)計,且臨床評價資料可證明,申報產(chǎn)品的絕對效應(yīng)和安全性指標(biāo)評價不差于已上市同類產(chǎn)品。
需盡可能地采用盲法以避免主觀影響因素,如對受試者設(shè)盲及對第三方評價者設(shè)盲。如果可行,建議還應(yīng)對注射操作者設(shè)盲。
本部分僅對本指導(dǎo)原則提及的適應(yīng)證進(jìn)行舉例討論。
1.主要有效性評價指標(biāo)
如對于注射用重組Ⅲ型人源化膠原蛋白溶液,若適用范圍為該產(chǎn)品用于面部真皮組織填充以糾正額部動力性皺紋(包括眉間紋、額頭紋和魚尾紋)或?qū)τ诰廴樗崦娌刻畛鋭┊a(chǎn)品,若適用范圍為用于注射到真皮深層,以糾正中重度鼻唇溝皺紋。建議將所宣稱的效果持續(xù)時間點上的對皺紋糾正的有效率設(shè)為主要有效性評價指標(biāo)。皺紋糾正有效率定義為,皺紋嚴(yán)重程度的分級(如Wrinkle Severity Rating Scale, WSRS)較術(shù)前至少減輕一個等級的受試者例數(shù)百分比。對于同一受試者的雙側(cè)數(shù)據(jù),需明確取舍規(guī)則。表1提供了一個評價皺紋嚴(yán)重程度的量表示例。
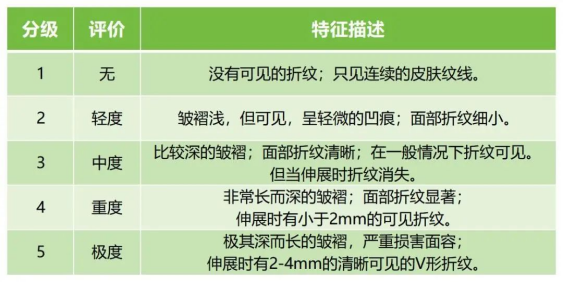
↑ 表1 評價皺紋嚴(yán)重程度參考量表(示例)
如對于注射用交聯(lián)透明質(zhì)酸鈉凝膠,若適用范圍為用于鼻背、鼻小柱和前鼻棘部位骨膜上層(硬骨膜上和/或軟骨膜上)注射,以改善外鼻體積及形態(tài)。建議將所宣稱的效果持續(xù)時間點上測量的鼻背和/或鼻根體積相對于基線的平均變化值設(shè)為主要有效性評價指標(biāo)。
如對于注射用交聯(lián)透明質(zhì)酸鈉凝膠,若適用范圍為用于矯正中面部容量缺失和/或中面部輪廓缺陷,注射層次為皮下組織、骨膜上層。建議將觀察末次注射后所宣稱的效果持續(xù)時間點時的治療有效率作為主要評價指標(biāo)。如可采用面中部容量量表評分 (Medicis Mid-Face Volume Scale,MMVS,見表2)或面中部容積缺陷量表評分(Mid-Face Volume Deficit Scale,MFVDS,見表3),且與基線相比,評分顯示改善≥1級的受試者被視為治療有效。
表2和表3分別提供面中部美容效果評價的兩種示例。

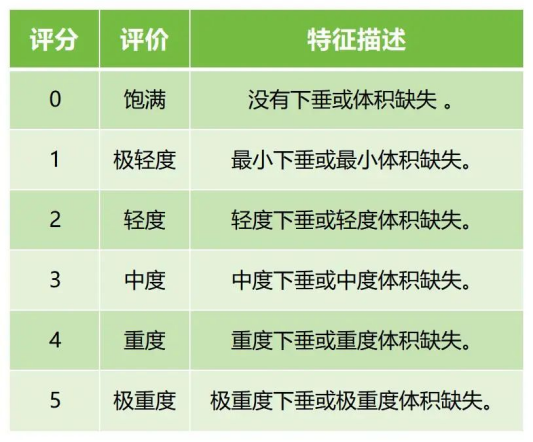
↑ 表3 面中部容積缺陷量評分量表(MFVDS)(示例)
如對于注射用交聯(lián)透明質(zhì)酸鈉凝膠,若適用范圍為通過注射至唇紅體和唇紅緣的唇粘膜下層、真皮淺層或中層,以矯正唇部不對稱、輪廓畸形和容積缺損等結(jié)構(gòu)缺陷。建議將觀察末次注射后所宣稱的效果持續(xù)時間點訪視時的豐唇治療效果作為主要評價指標(biāo)。如可采用嘴唇豐滿度量表評分(Lip Fullness Scale2, LFS2,見表4),與基線相比,LFS2評分顯示改善(豐滿度增加)≥1級的受試者被視為豐唇有效。
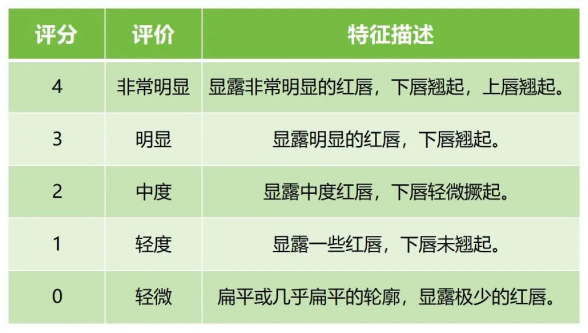
↑ 表4 唇部豐滿度參考量表(LFS2)(示例)
如對于注射用交聯(lián)透明質(zhì)酸鈉凝膠,若適用范圍為用于注射到骨膜上層,填充下頜區(qū)域,以改善輕度至中度下頜后縮患者的下頜輪廓。建議將觀察末次注射后的治療有效率作為主要評價指標(biāo)。如可采用Galderma下頜后縮評估量表評分(GCRS,見表5)。與基線相比,GCRS評分顯示改善≥1級的受試者被視為治療有效。

↑ 表5 Galderma下頜后縮評估量表(GCRS)(示例)
有效性評價一般由獨立于注射操作者的專業(yè)人員進(jìn)行評估。若采用其他指標(biāo)作為主要有效性評價指標(biāo)需提供充分依據(jù),如主要評價指標(biāo)采用其他評價皺紋嚴(yán)重程度參考量表,量表應(yīng)經(jīng)過驗證并建議向臨床機(jī)構(gòu)提供各分級相對應(yīng)的皺紋圖片以方便研究者進(jìn)行參考判斷分級。
試驗方案中需明確主要評價指標(biāo)采集數(shù)據(jù)的方法(如現(xiàn)場評判還是根據(jù)照片評判),需采取措施盡量減小其他因素(如環(huán)境光線、觀察或拍照角度等)對評判結(jié)果造成的影響。如采集數(shù)據(jù)采用臨床公認(rèn)的設(shè)備測量,需明確設(shè)備名稱、型號、生產(chǎn)廠家等基本信息,并提供其測量結(jié)果準(zhǔn)確性的研究驗證資料,如設(shè)備按照醫(yī)療器械管理需取得醫(yī)療器械注冊證。
2.次要有效性評價指標(biāo)
次要有效性評價指標(biāo)建議包括研究者的整體美觀改善效果評價(Global Aesthetic Improvement Scale, GAIS),受試者的整體美觀改善效果評價(GAIS)。
表6提供了全局美容效果評價分級的一個示例。
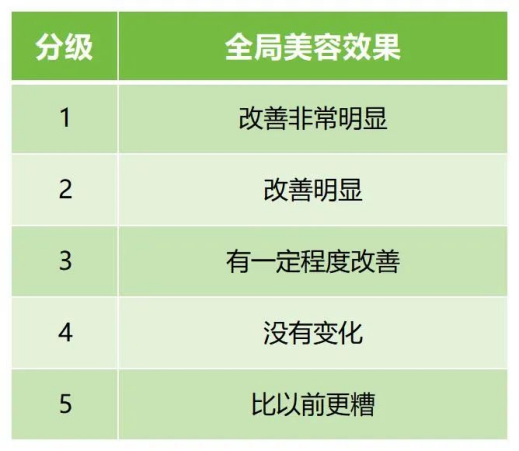
↑ 表6 面部整體面容效果改善效果分級量表(GAIS)(示例)
如對于注射用重組Ⅲ型人源化膠原蛋白溶液,若適用范圍為該產(chǎn)品用于面部真皮組織填充以糾正額部動力性皺紋(包括眉間紋、額頭紋和魚尾紋)或?qū)τ诰廴樗崦娌刻畛鋭┊a(chǎn)品,若適用范圍為用于注射到真皮深層,以糾正中重度鼻唇溝皺紋;次要評價指標(biāo)一般還應(yīng)包括研究者對除主要有效性評價觀察時間點外其他時間點的皺紋嚴(yán)重程度的評價(WSRS)。
如對于注射用交聯(lián)透明質(zhì)酸鈉凝膠,若適用范圍為用于矯正中面部容量缺失和/或中面部輪廓缺陷,注射層次為皮下組織、骨膜上層;次要評價指標(biāo)一般還應(yīng)包括研究者對輪廓填充效果評價。
如對于注射用交聯(lián)透明質(zhì)酸鈉凝膠,若適用范圍為用于鼻背、鼻小柱和前鼻棘部位骨膜上層(硬骨膜上和/或軟骨膜上)注射,以改善外鼻體積及形態(tài);次要評價指標(biāo)對采用測量設(shè)備評價外鼻正中矢狀面增高情況也進(jìn)行評價。
臨床試驗的次要評價指標(biāo)注射后觀察時間需根據(jù)產(chǎn)品維持有效性的時間和產(chǎn)品預(yù)期降解所需的時間確定。觀察時間點的設(shè)定應(yīng)至少包括注射前、注射后即刻、觀察隨療效變化情況的各時間點。
如,用于鼻唇溝未經(jīng)交聯(lián)的透明質(zhì)酸鈉產(chǎn)品臨床試驗注射后的持續(xù)觀察時間建議不短于6個月。用于鼻唇溝經(jīng)交聯(lián)的透明質(zhì)酸鈉凝膠產(chǎn)品臨床試驗注射后的持續(xù)觀察時間建議不短于1年。對于其他材料的面部注射填充材料,若經(jīng)動物試驗驗證,如降解時間較短,建議有效性評價時間至少觀察至產(chǎn)品完全降解;如降解時間較長,建議結(jié)合產(chǎn)品的降解時間適當(dāng)延長產(chǎn)品的有效性評價時間,一般應(yīng)觀察至降解穩(wěn)態(tài)(如1年),并在后續(xù)的臨床使用過程中系統(tǒng)觀察產(chǎn)品的中遠(yuǎn)期的效果。
對于含利多卡因的透明質(zhì)酸鈉凝膠,考慮到產(chǎn)品含利多卡因的濃度、給藥方式和劑量與現(xiàn)有臨床應(yīng)用情形不同。建議在次要評價指標(biāo)中關(guān)注14天內(nèi)的疼痛改善情況(如,可采用VAS評分標(biāo)準(zhǔn)),并與對照組進(jìn)行對比。
3.安全性評價指標(biāo)
安全性評價指標(biāo)應(yīng)包括,基本生命體征、注射前和注射后各有效性評價時間點的實驗室檢查(如血、尿常規(guī)檢查、肝功能檢查、腎功能檢查)等,對中遠(yuǎn)期注射部位周圍組織的影響、填充材料移位堆積情況。對于降解時間較長或不可降解等材料,還需關(guān)注填充材料游離風(fēng)險(包括位移風(fēng)險和材料碎片游離導(dǎo)致的栓塞風(fēng)險)。
注射填充過程存在非主觀性注射到血管內(nèi)的風(fēng)險,雖然發(fā)生率很低,但其造成的不良事件可能是嚴(yán)重且永久性的,包括視覺異常和失明。因此,建議申請人主動監(jiān)測受試者是否發(fā)生視覺障礙(包括但不限于視力喪失、視力模糊、雙重視覺、眼部或周圍區(qū)域疼痛、視野中的盲點或陰影、眼球運動困難等)。對于已出現(xiàn)視覺障礙的受試者需進(jìn)一步觀察對神經(jīng)系統(tǒng)的影響(如中樞神經(jīng)系統(tǒng)并發(fā)癥)。
除此之外,安全性評價指標(biāo)還需要包括對不良事件的觀察,可能包括:
1)注射反應(yīng):如進(jìn)針處滲血、輕度腫脹、瘀斑和疼痛等;
2)過敏反應(yīng)(包括速發(fā)性和遲發(fā)性):早期表現(xiàn)為紅斑、丘疹、蕁麻癥、血管性水腫、過敏性休克等;遠(yuǎn)期表現(xiàn)為遲發(fā)性紅斑和炎性肉芽腫;
3)感染:包括內(nèi)源性病原體被激活或外界病原體侵入,以及生物膜形成以及血管栓塞導(dǎo)致皮膚供血障礙繼發(fā)的感染等;表現(xiàn)為局部紅、腫、熱、痛,皮溫升高,腫脹,甚至膿腫形成,少數(shù)患者可出現(xiàn)全身性反應(yīng);
4)丁達(dá)爾現(xiàn)象:在皮膚較薄部位注射較多的透明質(zhì)酸或注射層次偏淺,引起局部皮膚在光線照時下呈現(xiàn)藍(lán)色;
5)結(jié)節(jié)和條索狀隆起(注射總量過多或者注射層次過淺所致);
6)肉芽腫反應(yīng):表現(xiàn)為注射部位出現(xiàn)皮膚紅斑、腫脹、變色和皮下結(jié)節(jié);
7)血管栓塞:常見栓塞部位為面部淺層血管,也可發(fā)生眼動脈及其分支,甚至顱內(nèi)動脈的栓塞,可導(dǎo)致組織壞死、失明甚至危及生命;
8)其他:如注射過淺過快阻礙真皮血管網(wǎng)血流可導(dǎo)致皮膚發(fā)白,注射過深造成填充不足,注射后毛細(xì)血管擴(kuò)張、局部刺激引起的紅、腫及感覺異常等遲發(fā)性炎癥反應(yīng)。
臨床試驗安全性評價指標(biāo)的觀察時間應(yīng)結(jié)合產(chǎn)品材料學(xué)特性和產(chǎn)品預(yù)期降解時間進(jìn)行設(shè)計。觀察時間點應(yīng)至少包括短期安全性評價時間點(如注射后1周或2周)、治療過程中安全性評價時間點及中遠(yuǎn)期安全性評價時間點。
建議收集受試者在注射后14天內(nèi)的局部反應(yīng)日志。若存在補(bǔ)充注射的情況(按照產(chǎn)品說明書中的使用方法),應(yīng)從補(bǔ)充注射之日起開始計算觀察時間點。建議對于降解時間較長或不降解的產(chǎn)品,安全性評價終點應(yīng)設(shè)計為產(chǎn)品達(dá)到降解穩(wěn)態(tài)(如1年),并在后續(xù)的臨床使用過程中繼續(xù)系統(tǒng)觀察產(chǎn)品的遠(yuǎn)期安全性。
信息來源:國家藥監(jiān)局器審中心
排版整理:金飛鷹藥械
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295