文章出處:行業(yè)干貨 網(wǎng)責任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2025-04-22
本文轉(zhuǎn)自“中國器審”公眾號
2023年1月27日,F(xiàn)DA和加拿大衛(wèi)生部共同啟動eSTAR試點工作。2023年6月9日,eSTAR系統(tǒng)開放,可用于向CDRH提交Pre-submission。自2023年10月1日起,除非獲得豁免,否則所有510(k)相關內(nèi)容必須使用eSTAR系統(tǒng)提交。自2025年10月1日起,De Novo申請也需使用eSTAR進行提交。該系統(tǒng)作為行業(yè)指導性提交準備工具,旨在提高提交一致性及審查過程的效率。
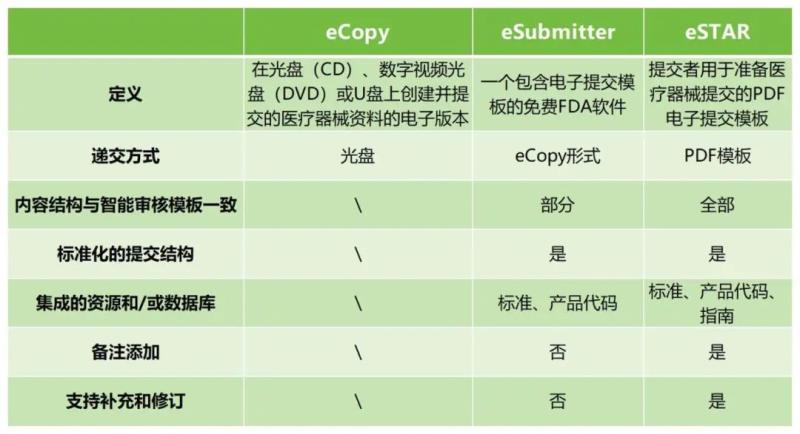
1.介紹。eSTAR系統(tǒng)是一種交互式PDF表格,可指導申請人通過準備全面的醫(yī)療設備提交過程。目前,eSTAR系統(tǒng)為自愿使用,旨在通過幫助申請人確認提交質(zhì)量和用于上市前確認的全面數(shù)據(jù),來提高大部分醫(yī)療器械的申請?zhí)峤毁|(zhì)量。同時,借助標準化的格式,提交者可以確保其提交內(nèi)容已完成,并且FDA可以更有效地進行上市前審查,以推動安全、有效和高質(zhì)量的醫(yī)療器械申報效率提升。由于使用自動驗證,F(xiàn)DA不打算在eSTAR中進行RTA審查提交。
2.特點。此模板特點主要有,自動化(例如,表單構造和自動填充);與FDA內(nèi)部審核模板互補的內(nèi)容和結構;集成多種資源(例如,指南和數(shù)據(jù)庫);遞交內(nèi)容結構具有指導性;自動驗證(不需要進行RTA 審查)。
3.使用人群。eSTAR是免費的,所有希望提交510(k)、De Novo和Pre-Submission到CDRH以及提交510(k)到CBER的醫(yī)療設備申請人可以自愿使用。eSTAR目前也可用于組合產(chǎn)品。
1.遞交文件表單自動化,整合指南和標準庫。在eSTAR PDF遞交模板中嵌入了FDA 510(k)遞交要求的表格,實現(xiàn)表單構建和自動填充,規(guī)范了填寫內(nèi)容和形式,減少前期文件上傳、填寫錯誤,方便后續(xù)自動驗證。同時,eSTAR具有自動識別填充的功能,能根據(jù)產(chǎn)品的描述,識別哪些是必須提供的信息,也能根據(jù)產(chǎn)品特點提供適宜的指導文件、資源或數(shù)據(jù),這有利于提高企業(yè)申請資料水平。
2.減少RTA 審查環(huán)節(jié),提高審查效率。使用eCopy的時候,容易因為文件中簡單的前后不一致等小問題,導致審核暫停并重新修改文件后快遞提交給FDA,使得510k審核周期會因為一些非實質(zhì)等效問題而拖延幾個月。而eSTAR通過自動化的表單,來實現(xiàn)自動驗證,F(xiàn)DA不再對eSTAR進行RTA審查,直接進入SE等效性審查,大大縮短審核時間以及eCOPY遞交時間。
3.與CDRH內(nèi)部審查模板互補的內(nèi)容結構。eSTAR表單與CDRH內(nèi)部審查互補,并且能夠添加備注,大大地提高審核的效率和質(zhì)量。同時,基于eSTAR是一個PDF模板的本質(zhì),F(xiàn)DA接收到的申請材料格式一致,也方便了審核。
eSTAR自動化、高集合、結構化的PDF表單能夠提高申請資料的質(zhì)量和一致性,減免RTA環(huán)節(jié),從而提高審核效率。
2019年6月24日,我國現(xiàn)有eRPS系統(tǒng)正式啟用,eRPS系統(tǒng)與醫(yī)療器械技術審評信息系統(tǒng)密切關聯(lián),實現(xiàn)了資料的電子審閱和流轉(zhuǎn)。eRPS系統(tǒng)的正式使用一是實現(xiàn)無紙化辦公,申報資料無需郵寄、無需排隊,提高了流轉(zhuǎn)效率;二是實現(xiàn)系統(tǒng)化資料,傳統(tǒng)紙質(zhì)資料結構層次不立體,審評較難查閱,通過設置申報資料填寫結構,立體展現(xiàn)產(chǎn)品研發(fā)思路;三是實現(xiàn)規(guī)范化管理,通過全過程留痕、全流程監(jiān)管,智能分配申報資料,保障資料安全性,優(yōu)化審評審批流程。我國eRPS系統(tǒng)與FDA的eSubmitter系統(tǒng)更為類似,主要目的為實現(xiàn)注冊申報資料的電子化流轉(zhuǎn)進程。
FDA的eSTAR系統(tǒng)覆蓋了申報510k的產(chǎn)品,該類產(chǎn)品主要為低風險及中風險的產(chǎn)品,并且有同類型已上市產(chǎn)品。而我國eRPS系統(tǒng)覆蓋了三類醫(yī)療器械申報,其中包含了植入等高風險產(chǎn)品,需進行更為嚴格的上市前審批。基于我國與FDA監(jiān)管體系的差異,eSTAR系統(tǒng)有幾點優(yōu)勢可為我國eRPS系統(tǒng)優(yōu)化提供思路。
1.參照審評思路優(yōu)化表單形式。eSTAR PDF遞交模板除了能夠?qū)崿F(xiàn)表單構建和自動填充,同時采用問答式的表單,使申請人在上傳相關資料的時候,能夠進一步梳理自己的申報思路和資料提交的系統(tǒng)性、完整性,更好的審核申報內(nèi)容。
2.整合多方數(shù)據(jù)庫于同一平臺。eSTAR嵌入了標準庫等數(shù)據(jù)庫,企業(yè)能夠在模板中選擇查看相應的標準及指導文件,減少了企業(yè)在不同網(wǎng)站查找相應文件的過程,有利于提高企業(yè)資料準備效率及準確性,進一步提升申請資料水平。
3.分產(chǎn)品開展立卷審查工作。參考eSTAR不再進行RTA審查的形式,建議我國可在產(chǎn)品申報階段設置選項,選擇不同的申報路徑,來區(qū)分立卷審查的方式,減少審評的壓力,聚焦重點產(chǎn)品的審查工作。
國家藥監(jiān)局高度重視智慧監(jiān)管工作推進,eRPS系統(tǒng)如何更好的將注冊申報相關資源(如標準、導則庫)整合,通過規(guī)范優(yōu)化系統(tǒng)流程來加強指引,eSTAR系統(tǒng)的推出或提供新思路。
1.eSTAR:Electronic Submission Template and Resource,提交者用于準備醫(yī)療器械提交的PDF電子提交模板;
2.CDRH:Center for Devices and Radiological Health器械和輻射健康中心;
3.Pre-submission:申請人自愿在產(chǎn)品注冊之前與FDA的溝通;
4.RTA:Refuse to Accept,拒絕接受指南,解釋CDRH預期用以評估是否可以接受510(K)遞交進行審核的程序和標準;
5.eSubmitter:一個包含電子提交模板的免費FDA軟件;
6.eCOPY:在光盤(CD)、數(shù)字視頻光盤(DVD)或U盤上創(chuàng)建并提交的醫(yī)療器械資料的電子版本;
7.SE:等效性審核。
參考文獻:
1.https://www.fda.gov/medical-devices/how-study-and-market-your-device/voluntary-estar-program
醫(yī)療器械注冊咨詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139