隨著智能化技術的蓬勃發(fā)展,醫(yī)療器械領域的通用語言——醫(yī)療器械唯一標識(UDI)已在醫(yī)療器械全生命周期監(jiān)管中扮演了舉足輕重的角色。全球實施統(tǒng)一UDI路徑將有助于醫(yī)療器械產品在供應鏈中的精準識別、產品追溯、召回等。無論企業(yè)布局的是國內還是國際市場,UDI的實施都已成為不可忽視的重要環(huán)節(jié)。
本期文章我們以簡單明了的表格形式對中國、美國和歐盟在UDI實施方面(如發(fā)碼機構、數(shù)據(jù)庫等)進行對比,以供大家參考。

總的來說,美國是全球范圍內最早實施UDI的國家,2007年,F(xiàn)DA補充法案修訂聯(lián)邦法案519條款,加入f部分,明確FDA實施UDI的法律基礎。2014年9月,要求Ⅲ類/植入式器械實施UDI,而歐盟和我國在UDI實施方面相對起步較晚,2017年5月,歐盟發(fā)布了醫(yī)療器械法規(guī)(MDR)和體外診斷醫(yī)療器械法規(guī)(IVDR),設立UDI專章,規(guī)定歐洲醫(yī)療器械數(shù)據(jù)庫(EUDAMED)相關建設內容。我國則在2019年7月確定了UDI試點品種,2021年1第一批產品正式實施UDI。以下為具體實施時間線:
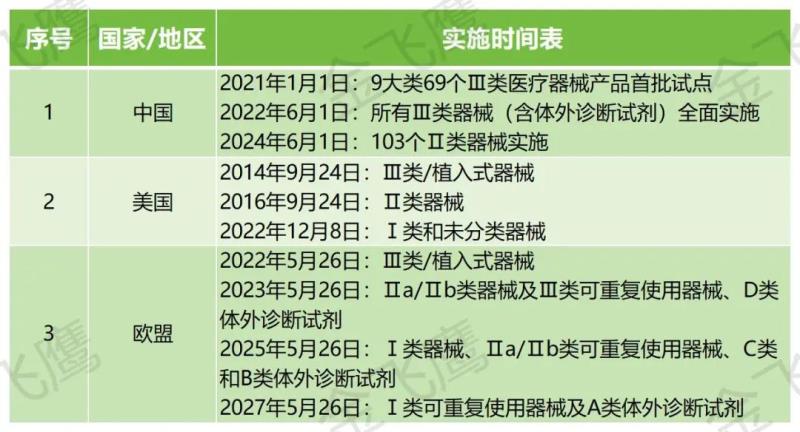
三者有一個共同發(fā)碼機構:GS1,因此假如企業(yè)銷售市場不僅僅局限于國內,就可以選擇GS1采用“多碼并行”的方式進行賦碼,一方面能夠減少編碼轉化的成本,另一方面能夠降低轉碼可能帶來的識別錯誤。

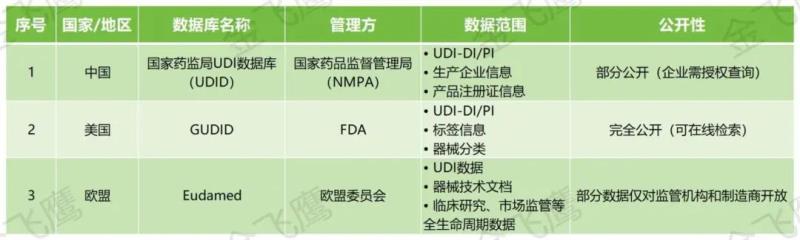
以上就是我們本期分享的中國、美國及歐盟UDI實施的相關內容,假如您有UDI實施需求,歡迎聯(lián)系我們咨詢!
另外,近期我們擬聯(lián)合蘇州優(yōu)迪艾數(shù)字醫(yī)療科技有限公司,在金飛鷹深圳總部舉辦一場【免費】UDI培訓沙龍,不僅為您詳細解讀UDI法規(guī)及實施細則,還將通過現(xiàn)場實操演示,帶您體驗從UDI賦碼到條碼打印的全過程。歡迎大家識別下方二維碼踴躍報名~

醫(yī)療器械注冊咨詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139
暫無留言