文章出處:行業(yè)干貨 網(wǎng)責任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-06-04
對于需要進行臨床試驗的醫(yī)械產(chǎn)品,通常來說,在臨床試驗開始前,臨床試驗申辦者應(yīng)當向所在地省、自治區(qū)、直轄市藥品監(jiān)督管理部門進行臨床試驗備案;而針對那些臨床試驗對人體具有較高風險的產(chǎn)品,還應(yīng)當經(jīng)國家藥監(jiān)局批準。根據(jù)《醫(yī)療器械注冊與備案管理辦法》第三十八條:
第三類醫(yī)療器械進行臨床試驗對人體具有較高風險的,應(yīng)當經(jīng)國家藥品監(jiān)督管理局批準。 臨床試驗審批是指國家藥品監(jiān)督管理局根據(jù)申請人的申請,對擬開展臨床試驗的醫(yī)療器械的風險程度、臨床試驗方案、臨床受益與風險對比分析報告等進行綜合分析,以決定是否同意開展臨床試驗的過程。 需進行臨床試驗審批的第三類醫(yī)療器械目錄由國家藥品監(jiān)督管理局制定、調(diào)整并公布。需進行臨床試驗審批的第三類醫(yī)療器械臨床試驗應(yīng)在符合要求的三級甲等醫(yī)療機構(gòu)開展。
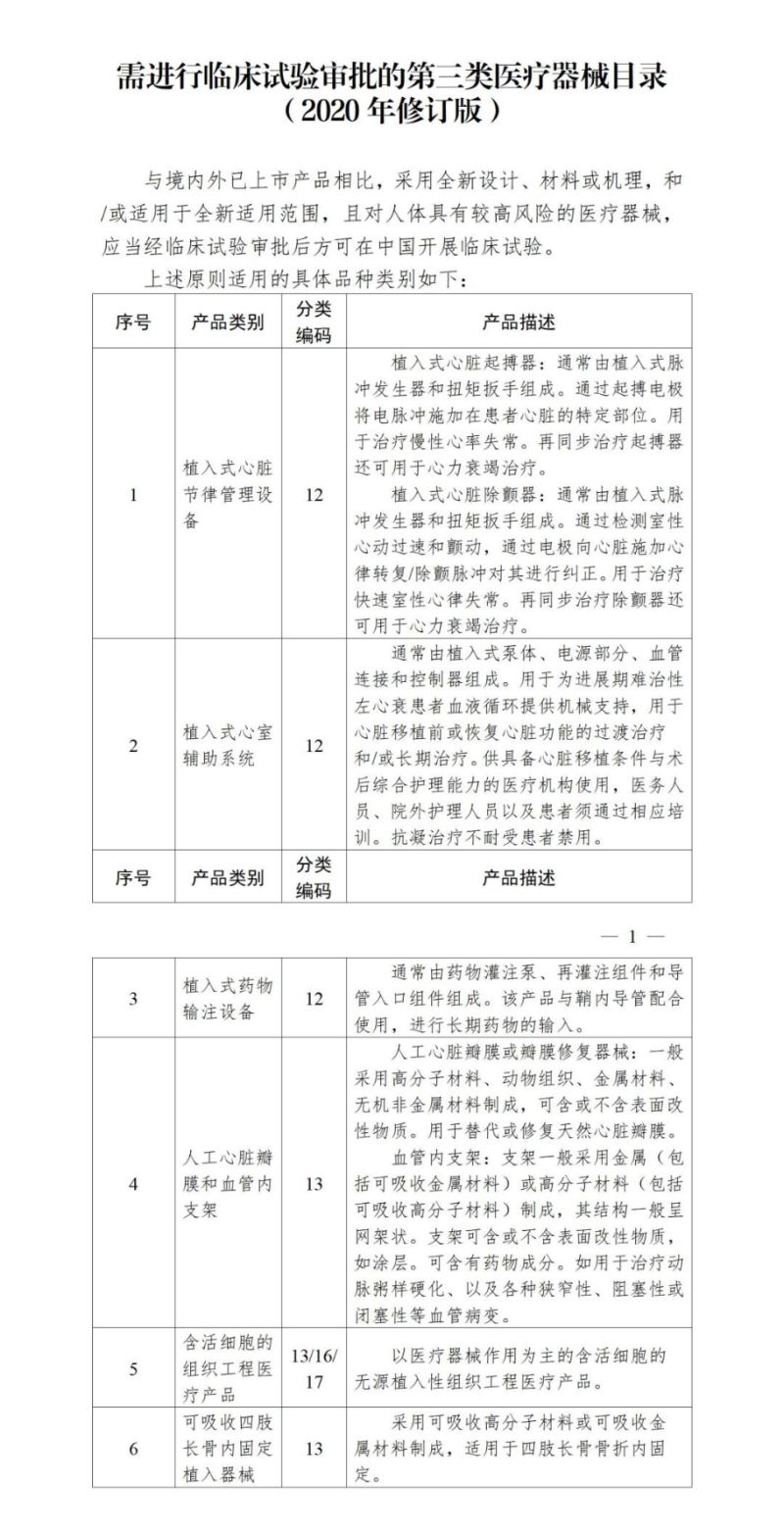
那么目前有哪些醫(yī)療器械產(chǎn)品需進行臨床試驗審批呢?根據(jù)《國家藥監(jiān)局關(guān)于發(fā)布需進行臨床試驗審批的第三類醫(yī)療器械目錄(2020年修訂版)的通告(2020年第61號)》,需進行臨床試驗審批的第三類醫(yī)療器械產(chǎn)品包括植入式心臟節(jié)律管理設(shè)備、植入式心室輔助系統(tǒng)等,具體如下:
醫(yī)療器械注冊咨詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052