法規(guī)動態(tài)
您的位置:首頁新聞資訊法規(guī)動態(tài)
您的位置:首頁新聞資訊法規(guī)動態(tài)
文章出處:法規(guī)動態(tài) 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2024-02-28
歐洲當(dāng)?shù)貢r間11月29日,歐盟發(fā)布了一份MDCG文件"Notice to manufacturers and notified bodies to ensure timely compliance with MDR and IVDR requirements",這是去年歐盟發(fā)布的MDCG 2022-11的修訂版本,旨在呼吁制造商及公告機構(gòu)盡快滿足MDR及IVDR的要求。
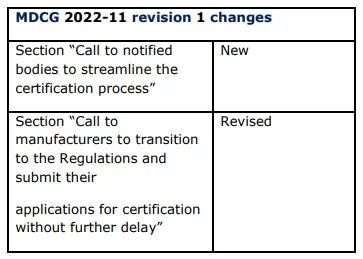
較之去年發(fā)布的MDCG 2022-11,本次修訂版本主要如下:
新增內(nèi)容:呼吁公告機構(gòu)簡化認(rèn)證流程
修訂內(nèi)容:呼吁制造商盡快完成從MDD/IVDD到MDR/IVDR的過渡,不要再延遲提交認(rèn)證申請
文件指出,迄今為止,共有40家MDR指定公告機構(gòu)及12家IVDR公告機構(gòu),但相較于之前MDD/IVDD證書數(shù)量,制造商目前提交的MDR/IVDR認(rèn)證申請數(shù)量仍然很低。因此,在本份修訂文件中,歐盟對制造商及公告機構(gòu)分別提出了以下要求:
MDCG強調(diào),制造商應(yīng)利用好MDR/IVDR修訂文件中給出的過渡期規(guī)定,在合適的時間內(nèi)提交認(rèn)證申請,否則可能導(dǎo)致公告機構(gòu)無法短時間(公告機構(gòu)數(shù)據(jù)顯示:MDD下符合性評定時間平均約為12個月,而MDR下則要18到24個月;IVDD下12個月,IVDR則平均要18個月)內(nèi)處理大量認(rèn)證申請并進一步導(dǎo)致市場上的產(chǎn)品短缺。
D類IVD的制造商尤其如此,他們必須在2025年5月前過渡到IVDR。強烈建議此類制造商在2023年底前提交認(rèn)證申請。
同時,制造商應(yīng)定期提供有關(guān)其設(shè)備情況的數(shù)據(jù),以便歐盟能持續(xù)監(jiān)測MDR和IVDR的認(rèn)證進度。
總的來說,歐盟呼吁公告機構(gòu)讓認(rèn)證過程更加高效、透明和可預(yù)測。具體說來,有如下建議:
根據(jù)一致、公平和合理的條款和條件,特別考慮中小企業(yè)在費用方面的利益
為制造商提供有關(guān)如何申請符合性評定程序的監(jiān)管指導(dǎo)和技術(shù)支持
組織與制造商的結(jié)構(gòu)化對話
定期公開相關(guān)設(shè)備認(rèn)證的數(shù)據(jù)
提升符合性評定程序評估能力及時間的透明度
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295