歐盟更新公告機構(gòu)相關(guān)要求指南文件
文章出處:公告通知
網(wǎng)責(zé)任編輯:
金飛鷹
閱讀量:
發(fā)表時間:2025-02-18
歐盟CE
公告機構(gòu)

近日,歐盟發(fā)布了有關(guān)公告機構(gòu)要求問答的指南文件MDCG 2019-6 rev.5,對該指南文件進行了以下更新:
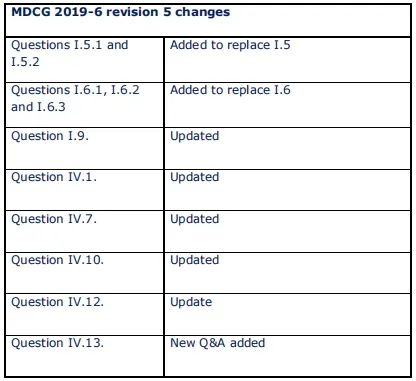
據(jù)上圖我們可以看到,本次更新內(nèi)容最多的為第四部分“PROCESS REQUIREMENTS”,我們將本部分新增問答Question IV.13.轉(zhuǎn)載如下:Q:什么可以被認(rèn)為是“可利用證據(jù)”?A:根據(jù)MCG 2022-14行動項目2,公告機構(gòu)在執(zhí)行其符合性評估活動時應(yīng)避免不必要的重復(fù)工作。在這方面,需要在制造商提供的證據(jù)和公告機構(gòu)已經(jīng)進行的證據(jù)評估之間做出區(qū)分。作為結(jié)構(gòu)化對話的一部分(參見Q&A I.6.3),對于(a)特定設(shè)備,制造商和公告機構(gòu)應(yīng)在預(yù)申請階段討論并同意制造商提供的哪些先前申請中的證據(jù)可以引用。原則上,只要制造商提供的證據(jù)仍然符合“最新技術(shù)水平”,這是可能的。為了促進這種做法,制造商應(yīng)清楚地指出與先前版本相比,技術(shù)文件的哪些部分發(fā)生了變化。公告機構(gòu)應(yīng)部分利用先前對這些證據(jù)進行的評估。這通常被推薦,只要:適用的評估要求(包括用于證明符合要求的協(xié)調(diào)標(biāo)準(zhǔn)和通用規(guī)范)沒有改變,
評估是由明顯符合法規(guī)資格要求的人員進行的,
適用的報告要求在法規(guī)附件VII第4.6節(jié)中得到滿足,并確保可追溯性。
在這種情況下,報告應(yīng)識別通過利用先前評估中的證據(jù)對技術(shù)文件的哪部分進行了評估,并確保可追溯性。
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139

