在醫(yī)療器械研發(fā)注冊過程中,建立完善的質(zhì)量管理體系是極為重要的一環(huán),這是醫(yī)療器械安全性和有效性的重要保障。
《醫(yī)療器械監(jiān)督管理條例》第三十五條規(guī)定:“醫(yī)療器械注冊人、備案人、受托生產(chǎn)企業(yè)應當按照醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范,建立健全與所生產(chǎn)醫(yī)療器械相適應的質(zhì)量管理體系并保證其有效運行。”
對質(zhì)量管理體系的要求是全球范圍內(nèi)的業(yè)內(nèi)共識,除我國外,其他國家對質(zhì)量管理體系也都有自己的法規(guī)要求及審核標準,審核通過后,醫(yī)療器械產(chǎn)品方可合法進入目標市場。本次,我們就來聊一聊在國外質(zhì)量管理體系中應用較廣的項目——MDSAP。
MDSAP是Medical Device Single Audit Program(醫(yī)療器械一體化審核程序)的英文縮寫,是由IMDRF(國際醫(yī)療器械監(jiān)管者論壇)發(fā)起的一體化審核程序,旨在通過單一質(zhì)量管理體系(QMS)審核使制造商滿足參與國的QMS要求。
目前,參與并認可MDSAP的國家有:澳大利亞(TGA)、巴西(ANVISA)、加拿大(HC)、日本(PMDA)、美國(FDA)。對于想把醫(yī)療器械產(chǎn)品同時銷往以上國家的企業(yè)來說,做一個MDSAP體系認證就是最便捷省事的方式了。
那么,MDSAP審核內(nèi)容都有哪些?各國法規(guī)對此又有哪些具體要求呢?
11月3日下午3點,金飛鷹項目部負責人、從事工業(yè)企業(yè)管理15年,輔導企業(yè)近200家,尤為擅長MDSAP、ISO 13485、QSR 820、ISO 9001等管理體系培訓的金宏星老師,為您帶來《MDSAP多國體系認證審評要點》,培訓內(nèi)容包括MDSAP基礎知識、審核內(nèi)容、各國法規(guī)要求,超多干貨,不容錯過!
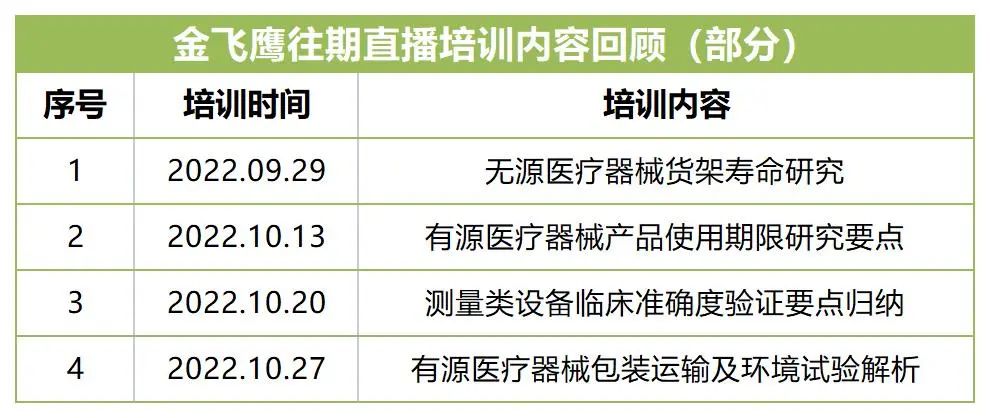
溫馨提醒:為防止錯過培訓時間,記得識別下方二維碼提前預約~? 金飛鷹直播培訓簡介 金飛鷹直播培訓,是每周一次的固定培訓欄目,優(yōu)選金飛鷹國內(nèi)外資深注冊/項目老師定期為大家講解醫(yī)療器械注冊相關知識,解答大家在醫(yī)療器械注冊過程中的諸多疑問。此前已為大家?guī)磲t(yī)療器械生物學評價、無菌醫(yī)療器械的滅菌方法及驗證、醫(yī)療器軟件注冊、加拿大醫(yī)療器械注冊等共計18次培訓課程,最近的4次課程內(nèi)容回顧如下: 往期直播培訓課程支持回放,關注“金飛鷹藥械咨詢服務”視頻號并點擊視頻號主頁,即可查看“直播回放”哦~ 醫(yī)療器械注冊咨詢認準金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295