文章出處:公告通知 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時(shí)間:2024-02-29
5月31日,國家藥監(jiān)局器審中心發(fā)布《體外診斷試劑變更注冊審查指導(dǎo)原則(征求意見稿)》(以下簡稱《指導(dǎo)原則》),并向社會(huì)公開征求意見。
意見反饋時(shí)間:2023年6月30日前 意見反饋郵箱:[email protected] /[email protected]
為方便大家迅速掌握重點(diǎn),我們將部分重點(diǎn)內(nèi)容摘錄如下:
本指導(dǎo)原則適用于體外診斷試劑的變更注冊,即醫(yī)療器械注冊證及產(chǎn)品技術(shù)要求、產(chǎn)品說明書載明的內(nèi)容發(fā)生變化的情況。本指導(dǎo)原則涵蓋的變更情況包括體外診斷試劑變更注冊申報(bào)資料要求及說明中綜述資料部分產(chǎn)品變更情況描述的12種情況。
體外診斷試劑發(fā)生變化均應(yīng)通過質(zhì)量管理體系進(jìn)行控制,如涉及醫(yī)療器械注冊證及其附件載明的內(nèi)容發(fā)生變化,需進(jìn)行變更備案或變更注冊(圖1)。
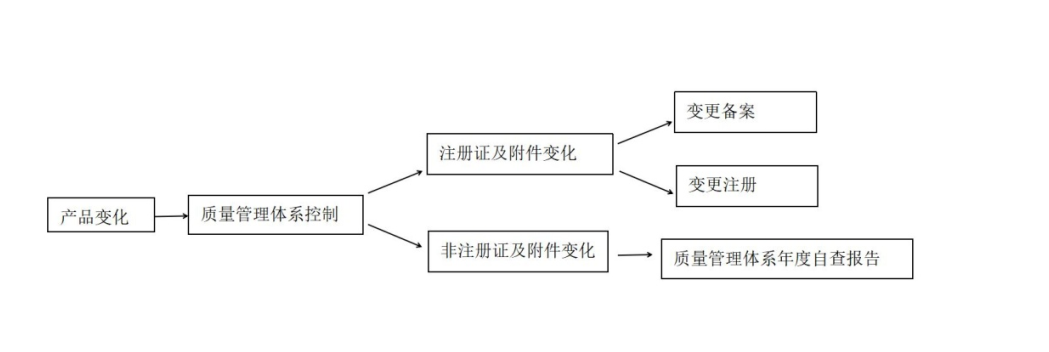
注冊人名稱和住所、代理人和代理人住所變化,境內(nèi)體外診斷試劑生產(chǎn)地址變化并已辦理相應(yīng)的生產(chǎn)許可,屬于需要變更備案的事項(xiàng)。
變更注冊事項(xiàng)的情形較多,注冊人需根據(jù)具體變更內(nèi)容進(jìn)行風(fēng)險(xiǎn)分析和技術(shù)評價(jià)。綜合風(fēng)險(xiǎn)/受益分析,確定產(chǎn)品是否適宜進(jìn)行變更。
1. 產(chǎn)品名稱文字性變化。 2. 不影響性能或穩(wěn)定性的包裝規(guī)格變化:產(chǎn)品組成的最小包裝不變,僅包裝數(shù)量發(fā)生變化。 3. 說明書中增加警示信息。 4. 刪除適用機(jī)型。 5. 進(jìn)口體外診斷試劑生產(chǎn)地址的文字變化。 6. 其他不影響產(chǎn)品性能的變化。
大部分的變更屬于有潛在風(fēng)險(xiǎn)的情形,即產(chǎn)品發(fā)生的變化有導(dǎo)致新風(fēng)險(xiǎn)或改變現(xiàn)有風(fēng)險(xiǎn)的可能性。需要進(jìn)行非臨床研究和/或臨床評價(jià),確定不增加風(fēng)險(xiǎn),或者雖然提高了部分風(fēng)險(xiǎn),但是剩余風(fēng)險(xiǎn)可接受,同時(shí)顯著提高受益,這種情況下建議進(jìn)行變更注冊。如果產(chǎn)品變化導(dǎo)致風(fēng)險(xiǎn)增加,且未顯著提高受益,例如產(chǎn)品性能指標(biāo)降低等,則不建議變更。
非臨床的試驗(yàn)研究主要包括主要原材料研究,生產(chǎn)工藝研究,反應(yīng)體系研究、檢驗(yàn)報(bào)告,分析性能研究,穩(wěn)定性研究,陽性判斷值或參考區(qū)間研究等。
臨床評價(jià)方式主要包括臨床試驗(yàn)和免于進(jìn)行臨床試驗(yàn)的體外診斷試劑臨床評價(jià)。根據(jù)變更可能導(dǎo)致的潛在風(fēng)險(xiǎn),選擇需要進(jìn)行的非臨床研究和/或臨床評價(jià)。
包裝規(guī)格變化時(shí),需要根據(jù)變更前后包裝規(guī)格的具體差異,識別潛在風(fēng)險(xiǎn),并針對這些風(fēng)險(xiǎn)因素進(jìn)行驗(yàn)證。例如變更前后包裝規(guī)格的包裝形式(如PCR檢測產(chǎn)品大包裝和單管單人份包裝)、反應(yīng)形式(如膠體金檢測卡型、杯型)存在差異,應(yīng)進(jìn)行變更后包裝規(guī)格的分析性能研究。包裝形式、裝量或容器等發(fā)生變化,導(dǎo)致其蒸發(fā)、損耗等風(fēng)險(xiǎn)增加,應(yīng)考慮產(chǎn)品的貨架有效期、使用穩(wěn)定性等是否發(fā)生變化,進(jìn)行對應(yīng)的穩(wěn)定性研究。
產(chǎn)品儲存條件及有效期變化需要進(jìn)行穩(wěn)定性研究。
增加適用機(jī)型,需要采用新增機(jī)型進(jìn)行性能研究。可按照性能建立的方式進(jìn)行研究,亦可在比較新增機(jī)型與變更前機(jī)型工作原理、檢測方法、反應(yīng)條件控制、信號處理等方面一致的前提下,基于風(fēng)險(xiǎn)分析對已批準(zhǔn)產(chǎn)品的性能指標(biāo)進(jìn)行合理驗(yàn)證。由于不同機(jī)型的操作一般存在差異,所以無論進(jìn)行性能建立還是性能驗(yàn)證,其中的精密度研究均推薦采用新增機(jī)型進(jìn)行室內(nèi)精密度研究。新增機(jī)型的所有性能研究結(jié)果一般應(yīng)不低于變更前機(jī)型。
進(jìn)行機(jī)載穩(wěn)定性研究。
在性能研究過程中,還應(yīng)關(guān)注采用變更前后機(jī)型檢測獲得的量值/信號值是否存在差異,如果存在差異,需要考慮陽性判斷值是否發(fā)生變化。
陽性判斷值變化,一般需要進(jìn)行陽性判斷值研究,并進(jìn)行臨床評價(jià);參考區(qū)間變化,應(yīng)進(jìn)行參考區(qū)間的建立或驗(yàn)證。
對于產(chǎn)品技術(shù)要求附錄中載明的原材料變化,未實(shí)質(zhì)構(gòu)成新產(chǎn)品的情形,例如DNA聚合酶、dNTP等參與核心反應(yīng)體系的原材料及內(nèi)標(biāo)變化等,需要對變化后的原材料進(jìn)行研究,確保原材料質(zhì)量標(biāo)準(zhǔn)不降低。產(chǎn)品的生產(chǎn)工藝、反應(yīng)體系、分析性能、陽性判斷值或參考區(qū)間、穩(wěn)定性、臨床性能等可能會(huì)受到原材料變化的影響,需要在風(fēng)險(xiǎn)分析的基礎(chǔ)上,針對原材料的固定搭配組合重新進(jìn)行研究。提交前述研究資料,主要原材料研究資料,產(chǎn)品技術(shù)要求及檢驗(yàn)報(bào)告。
第三類體外診斷試劑產(chǎn)品技術(shù)要求中載明的生產(chǎn)工藝內(nèi)容發(fā)生變化,需要進(jìn)行生產(chǎn)工藝研究,確認(rèn)變更后生產(chǎn)工藝的合理性,并進(jìn)行非臨床研究,必要時(shí)進(jìn)行臨床評價(jià)。
反應(yīng)體系包括樣本的制備方式(采集和處理)、樣本要求、樣本用量、試劑用量、反應(yīng)條件、校準(zhǔn)方法(如有)、質(zhì)控方法、結(jié)果判讀方式等。對于產(chǎn)品說明書中載明的反應(yīng)體系發(fā)生變化的情形,需要對變化后的反應(yīng)體系進(jìn)行研究,確認(rèn)變更后反應(yīng)體系的合理性,并進(jìn)行分析性能研究。對比變更前后產(chǎn)品性能和量值/信號值的差異,考慮陽性判斷值是否發(fā)生變化。反應(yīng)體系如樣本用量、試劑用量、反應(yīng)條件等要素的顯著變化,還需進(jìn)行臨床評價(jià)。
如產(chǎn)品組成發(fā)生變化,還需考慮進(jìn)行穩(wěn)定性研究。
進(jìn)口體外診斷試劑生產(chǎn)地址發(fā)生變化,需要使用在新的生產(chǎn)地址生產(chǎn)的試劑進(jìn)行分析性能研究。
可比樣本,一般指性能指標(biāo)相同、陽性判斷值或參考區(qū)間相同、預(yù)期人群一致、臨床意義相同等。反之,則應(yīng)視為不可比樣本。
可比性樣本:對具有可比性的樣本類型,可選擇具有統(tǒng)計(jì)學(xué)意義數(shù)量的樣本進(jìn)行樣本一致性的同源比對研究。
不可比樣本:對于不具有可比性的樣本類型,應(yīng)對每種樣本類型分別進(jìn)行分析性能評估、陽性判斷值或參考區(qū)間研究、臨床評價(jià)。
增加的樣本類型,還需對新增的樣本類型進(jìn)行穩(wěn)定性研究。
適用人群變化,臨床適應(yīng)證發(fā)生變化,原則上需要進(jìn)行臨床評價(jià),如涉及產(chǎn)品分析性能、陽性判斷值或參考區(qū)間、企業(yè)參考品等變化的需進(jìn)行相應(yīng)研究。
產(chǎn)品技術(shù)要求、說明書變化可能涉及上述任何情形,需要根據(jù)具體變化內(nèi)容,進(jìn)行判斷。如技術(shù)要求中的性能指標(biāo)或檢驗(yàn)方法發(fā)生變化,需提交檢驗(yàn)報(bào)告。
對于涉及產(chǎn)品臨床性能的變化,包括非臨床研究結(jié)果顯示影響臨床性能的變化,均需要進(jìn)行臨床評價(jià)。
對于參與核心反應(yīng)體系的抗原、抗體來源改變或引物、探針核酸序列改變等情形,產(chǎn)品的核心反應(yīng)將發(fā)生變化,實(shí)質(zhì)上構(gòu)成了新產(chǎn)品,需要對變化后的產(chǎn)品重新進(jìn)行驗(yàn)證、確認(rèn),并按照產(chǎn)品注冊進(jìn)行辦理。
產(chǎn)品的核心技術(shù)原理等發(fā)生實(shí)質(zhì)性改變,或者發(fā)生其他重大改變、對產(chǎn)品安全有效性產(chǎn)生重大影響,實(shí)質(zhì)上構(gòu)成新的產(chǎn)品的,不適用變更注冊,應(yīng)當(dāng)按照產(chǎn)品注冊進(jìn)行辦理。
信息來源:國家藥監(jiān)局器審中心
排版整理:金飛鷹藥械
醫(yī)療器械注冊咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 湖南:0731-22881823 四川:028 - 68214295