文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2019-11-02
隨著ISO 10993-1:2018的發(fā)布,生物相容性評價再次成為了業(yè)內(nèi)討論的熱點,特別是大家所熟知的生物相容測試參考清單附錄A的整體更新,以及附錄B生物風(fēng)險管理整體引入ISO TR 15499的更新等,將對醫(yī)療器械生產(chǎn)商、注冊人及各檢驗機構(gòu)產(chǎn)生結(jié)構(gòu)性的影響。
ISO10993-1:2018取代了ISO 10993-1:2009,后者隨之失效。新版標(biāo)準(zhǔn)共計41頁,相比上一版的21頁,文字內(nèi)容上有不小的增幅。
首先,我們通過一個簡表來感受下新版本的生物相容性變化:
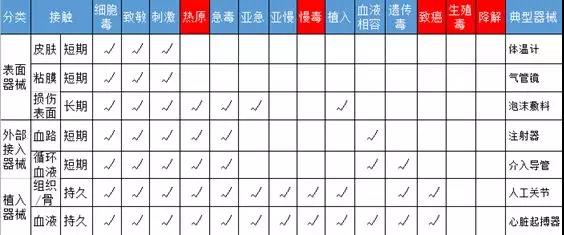
圖1 生物相容性測試項目簡表(部分)
Note:紅色為新增測試項目
針對新版標(biāo)準(zhǔn)增加或變化的部分,現(xiàn)根據(jù)ISO 10993-1:2018的排版順序,從標(biāo)準(zhǔn)正文即條款4 Generalprinciples為大家導(dǎo)讀:
General principles
4.1 引入了 physical/chemical information(物理/化學(xué)信息)的新概念,此項產(chǎn)品信息的獲取優(yōu)先度排在所有生物相容性測試
的前面,是新版生物學(xué)評價的第一步,并為隨后的其它生物相容性測試提供了產(chǎn)品信息依據(jù)。
新標(biāo)準(zhǔn) Figure 1 生物學(xué)風(fēng)險管理流程圖中也更新 physical/chemical information,并在流程圖第一排中增加了一個新的菱形
格 geometry and physical properties(結(jié)構(gòu)和物理性質(zhì))。同時,流程圖中還增加了 clinical use 作為風(fēng)險管理的評價項目,
可參考圖 2 所示。
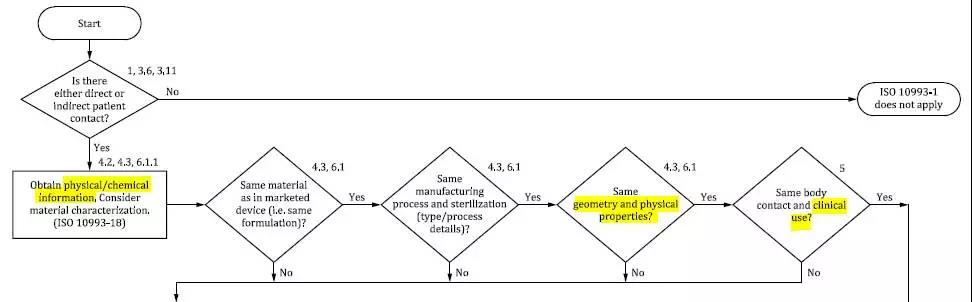
圖 2 摘自 ISO 10993-1:2018 Figure 1
4.3 c) packaging materials that directly or indirectly contact the medical device can transfer chemicals to the medical
device and then indirectly to the patient or clinician;
生物學(xué)評價因素新增加了對于包裝材料的考慮。
根據(jù)新版標(biāo)準(zhǔn),需要考慮包裝材料在貨架期內(nèi),是否會產(chǎn)生有害化學(xué)物質(zhì)影響醫(yī)療器械的安全性。比如生物心臟瓣膜需浸泡保存
在醛類溶液中,而盛放溶液的儲存罐材質(zhì)往往為工程塑料,這就需要考慮在其貨架期內(nèi),盛放溶液的儲存罐是否有化學(xué)物質(zhì)溶
出,進而影響到心臟瓣膜的安全性。
4.7 The biological safety of a medical device shall be evaluated by the manufacturer over the whole life-cycle of a
medical device.
新增條款,生產(chǎn)商對醫(yī)療器械的生物安全評價應(yīng)覆蓋醫(yī)療器械全生命周期。
此條款引入了全生命周期的生物學(xué)評價,也就是說生物學(xué)評價不再止步于生物相容性檢驗,隨后臨床試驗直至產(chǎn)品退市階段產(chǎn)生
的所有數(shù)據(jù)都將成為生物學(xué)評價報告更新的必要輸入。
4.8 For re-usable medical devices, biological safety shall be evaluated for the maximum number of validated
processing cycles by the manufacturer.
新增條款,對于可重復(fù)使用醫(yī)療器械,制造商應(yīng)對確認(rèn)過最大處理限度的醫(yī)療器械進行生物安全評價。
4.11 對于新版標(biāo)準(zhǔn)基本規(guī)則的一個補充說明:
1) 明確了新版發(fā)布前,已評價結(jié)束的醫(yī)療器械不需要增加新的生物相容性檢驗;
2)按照新版標(biāo)準(zhǔn),任何生物相容性檢驗項目的豁免都需要提供合理解釋;
3)歷史臨床資料可作為符合生物相容性要求的證據(jù)以豁免檢驗;
4)任何涉及生物相容性再評價的醫(yī)療器械,必須按照新版標(biāo)準(zhǔn)進行再評價。
5--Categorization of medical devices
5.1 General
明確了氣道類醫(yī)療器械的分類參照 ISO 18562 系列標(biāo)準(zhǔn)。
5.2.1 Non-contacting medical devices
新版標(biāo)準(zhǔn)覆蓋了非接觸類醫(yī)療器械,明確了非接觸類醫(yī)療器械不需要進行生物相容性檢驗,比如醫(yī)學(xué)診斷軟件,體外診斷設(shè)備以
及采血管等。
5.2.2 Surface-contacting medical devices
a) Skin
新版標(biāo)準(zhǔn)增加了 NOTE 解釋,明確了采用常規(guī)原材料的皮膚接觸器械無需更多的生物學(xué)評價。包括無手套接觸器械(如鍵盤、按
鈕、觸摸屏、SD 卡、U 盤等)和手套接觸器械(如導(dǎo)管的手柄)。
5.2.3 Externally communicating medical devices
b) Tissue/bone/dentin
Medical devices or components that do not necessarily directly contact tissue or bone but serve as conduits to
delivery fluids to the tissue or bone.
用于向組織或骨輸送液體的導(dǎo)管類器械,新版標(biāo)準(zhǔn)劃分為外部接入器械。
5.3 Categorization by duration of contact
5.3.1 Contact duration categories
c) Long-term exposure (C) – medical devices whose cumulative sum of single, multiple or repeated contact time
exceeds 30 d.
新版標(biāo)準(zhǔn)中,接觸超過 30 天的醫(yī)療器械采用 long-term 替換了 permanent,從表述上更加的嚴(yán)謹(jǐn)。比如心臟起搏器為長期植
入類醫(yī)療器械,但由于受限于電池容量,即使單腔起搏器也只能維持 7~8 年,并不能算作永久植入。
5.3.2 Transitory-contacting medical devices
增加了短暫接觸醫(yī)療器械的定義,規(guī)定接觸時間小于 1 分鐘的器械劃歸為短暫接觸類,比如柳葉刀、皮下注射針、毛細管等。
短暫接觸醫(yī)療器械通常不需要進行生物相容性檢驗,也未列入附錄 A,但此類器械若涉及累積使用(cumulative use),需要
另外評價。
6--Biological evaluation process
6.1 Physical and chemical information
新增條款,physical and chemical information 為生物相容性評價重要的第一步,具體實施可參考 ISO 10993-18,對于納米
材料可參考 2017 年新出的生物相容性標(biāo)準(zhǔn) ISO/TR 10993-22.
6.2 Gap analysis and selection of biological endpoints
新增條款,規(guī)定了差距分析的實施流程,應(yīng)參考附錄 A 的基礎(chǔ)上,結(jié)合附錄 CLiterature review(文獻綜述)進行判定。 基于
差距分析的結(jié)果,判定存在的潛在風(fēng)險,以決定需要選擇的生物相容性檢驗項目。
6.3 Biological testing
此次新版標(biāo)準(zhǔn)新增的測試項目主要參考了 FDA 關(guān)于 ISO 10993-1 使用指南 2016版附件 A 的內(nèi)容,這就意味著生物相容性測試
的 ISO 標(biāo)準(zhǔn)整體向 FDA 靠近,對于參考 ISO 10993-1 附錄 A 的醫(yī)療器械生產(chǎn)商來說是一個不小的挑戰(zhàn),特別是諸如慢毒、致
癌性等長期測試項目的加入。
ISO 10993-1 附錄 A 更新后,如下圖所示:
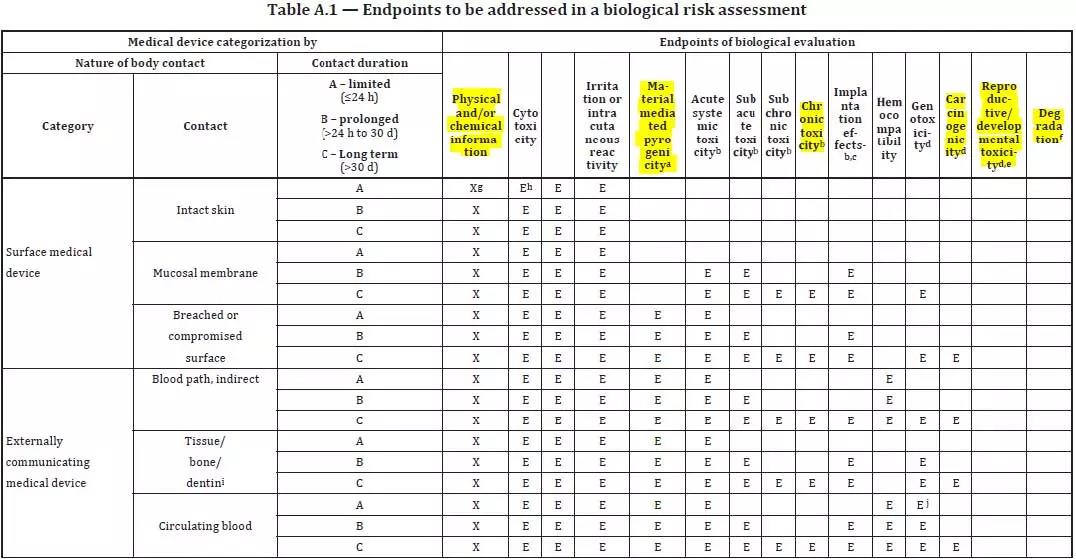
圖 3 摘選自 ISO 10993-1:18 附錄 A
1) 使用符號 E 代替上一版本的 X 以標(biāo)識生物相容性試驗終點;
2) 新版標(biāo)準(zhǔn)符號 X 表示生物學(xué)風(fēng)險評估需要的前置信息,如Physical and chemical information;
3) 增加了新的生物相容性試驗項目(如圖 3 標(biāo)黃所示):材料介導(dǎo)熱原、慢毒、致癌、生殖毒和可降解
6.3.2.5 Material-mediated pyrogenicity
附錄 A 新增測試項目,材料介導(dǎo)熱原。熱原分為內(nèi)毒素介導(dǎo)熱原和材料介導(dǎo)熱原,雖然材料介導(dǎo)熱原在一般醫(yī)療器械比較少見,
多見于生物衍生材料的器械,試驗方法多為家兔法。
6.3.2.8 Chronic toxicity
附錄 A 新增測試項目,慢性毒性。相比亞慢毒性,慢性毒性的檢驗周期會更長,比如 3 個月的小鼠亞慢,需要長達 6 個月的小
鼠慢毒。檢驗周期的加長對于醫(yī)療器械快速上市的節(jié)奏也會是一個不小的挑戰(zhàn),特別是諸多潛在的合規(guī)性風(fēng)險。
6.3.2.9 Implantation effects
對于植入試驗,新版標(biāo)準(zhǔn)有了重大更新,建議植入試驗方案可擴展為同時評價局部反應(yīng)和全身毒性,以滿足急性、亞急、亞慢和
慢毒測試的需求。如果可能,血液相容性評價也可以包含其中。
6.3.2.11 Carcinogenicity
附錄 A 新增測試項目,致癌性。對于一般醫(yī)療器械,致癌性試驗很少涉及,但對于接觸時間超過 30 天的醫(yī)療器械需要考慮。新
版標(biāo)準(zhǔn)建議,致癌性可以合并慢性毒試驗進行,具體可參考OECD Guideline 453.
6.3.2.12 Reproductive and developmental toxicity
附錄 A 新增測試項目,生殖毒性。對于一般醫(yī)療器械,生殖毒性試驗很少涉及,但對于預(yù)期使用人群為孕婦的醫(yī)療器械需要考慮。
6.3.2.13 Degradation
附錄 A 新增測試項目,可降解性。對于可降解醫(yī)療器械,使用體外法模擬臨床使用進行測試,當(dāng)體外測試無法得到足夠的數(shù)據(jù)以
證明其生物相容性時,需要考慮體內(nèi)降解試驗。降解試驗可參考的標(biāo)準(zhǔn)為 ISO 10993-9,ISO 10993-13,ISO 10993-14,
ISO 10993-15.
【總結(jié)】
ISO 10993-1:2009 伴隨著中國醫(yī)療器械高速發(fā)展的年代,從事無源醫(yī)療器械的同行都不會陌生,而此次時隔九年的更新改版,
也從一個側(cè)面說明了無源醫(yī)療器械即將開始升級換代,而監(jiān)管機構(gòu)對于生物相容性的測試要求同樣也已開始提高。