FDA QSR820驗廠輔導及改善483報告
美國國會是法律的制定機構.其制定的《聯(lián)邦食品藥品和化妝品法案(Federal Food, Drug and Cosmetic Act)》是美國關于醫(yī)療器械管理的最高法律性文件。
- 立即咨詢
-
全國服務熱線:
400-888-7587

400-888-7587
? 辦理介紹 / Introduction
? FDA QSR820也叫QSR (Quality System Regulation) ,是21 CFR 820的一種簡易叫法。
?美國國會是法律的制定機構.其制定的《聯(lián)邦食品藥品和化妝品法案(Federal Food, Drug and Cosmetic Act)》是美國關于醫(yī)療器械管理的最高法律性文件。
?美國食品藥品監(jiān)督管理局(FDA)是負責醫(yī)療器械管理的政府機構。其根據(jù)各相關法律授權而制定的各類法規(guī)性的文件編號為21CFRxxxx(xxxx為阿拉伯數(shù)字)。 其中21CFR820是FDA根據(jù)<聯(lián)邦食品,藥品和化妝品法案>第501、502、 510、 513、 514、 515、 518、 519、 520、 522、 701、 704、 801、 803條款的授權而制定的規(guī)范醫(yī)療器械企業(yè)質(zhì)量體系要求的法規(guī),即Quality System Regulation,簡稱QSR或QSR820。
?QSR 820質(zhì)量體系規(guī)范中描述了現(xiàn)行的生產(chǎn)管理規(guī)范的要求(CGMP)。本規(guī)范要求規(guī)定了所有醫(yī)用器械成品在設計、制造、包裝、標簽、貯存、安裝和服務中使用的方法,設施和控制。這些要求是為了確保醫(yī)療器械成品的安全和有效,并遵從美國食品藥品和化妝品法。本規(guī)范提出了適用于醫(yī)療器械成品制造商的基本要求,如果某制造商只進行本規(guī)范規(guī)定的一部分操作,而不進行其他操作,則該制造商僅需執(zhí)行適用于他所進行操作的那些要求。有關1類器械,設計控制僅按在§820.30(a)(2)中列出的要求進行。這個規(guī)范不適用于成品組件和零件的制造商,但鼓勵這樣的制造商使用規(guī)范的適當規(guī)定作為指導。
?現(xiàn)行版本的QSR820頒布于1996年10月7日,正式生效于1997年6月1日,亦被稱為美國醫(yī)療器械行業(yè)的現(xiàn)行良好的規(guī)范(Current Good Manufacture Practice,簡稱cGMP)。全文一共15個章節(jié):
A 總則
B 質(zhì)量體系要求
C 設計控制
D 文件控制
E 采購控制
F 識別與可追溯性
G 生產(chǎn)于過程控制
H 驗收活動
I 不合格產(chǎn)品
J 糾正與預防措施
K 標簽與包裝控制
L 搬運,存儲,發(fā)運與安裝
M 記錄
N 服務
O 統(tǒng)計技術
?總體而言,這是一套在結構上不同于IS013485要求上與IS013485基本相同,規(guī)定上更加明確的質(zhì)量管理體系法規(guī)。
? 辦理流程 / Processing process
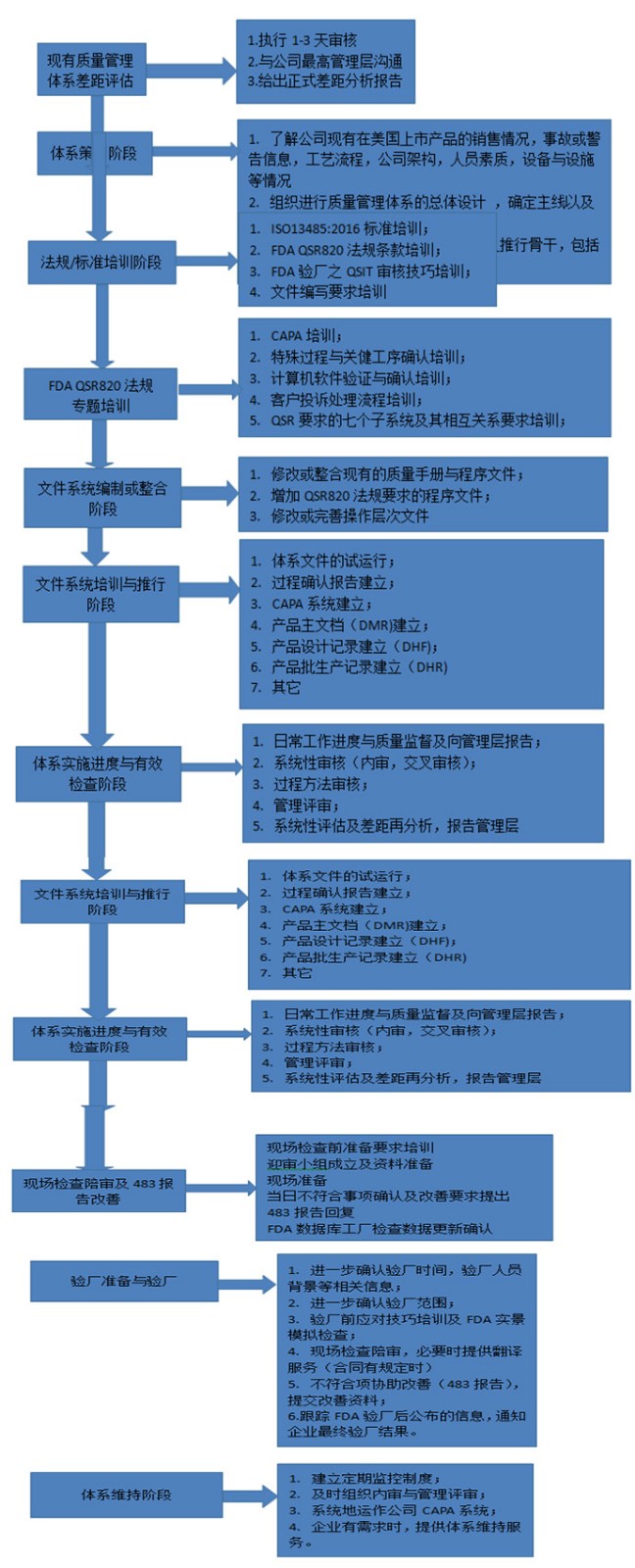
? 金飛鷹相關服務 / Golden Eagle related services
? 通用培訓服務
序號 | 培訓項目 | 顧問階段 | 培訓人員 |
1 | FDA QSR820條文講解與宣貫 | 導入標準 | 部門主管、文件編寫員 |
2 | FDAQSR820文件編寫培訓 | 系統(tǒng)建立 | 部門主管、文件編寫員 |
3 | 質(zhì)量體系文件實施前培訓 | 系統(tǒng)建立 | 各部門主管 |
4 | QSR820法規(guī)系列要求培訓 | 實施 | 全體人員 |
5 | FDA驗廠前應對技巧培訓 | 實施 | 內(nèi)審員、相關部門 |
6 | 管理評審培訓 | 實施 | 中層管理人員 |
7 | 統(tǒng)計技術培訓 | ||
8 | FDAQSR820實施前動員培訓 | 實施 | 相關人員 |
9 | FDAQSR820認證前宣貫培訓 | 取證 | 基層以上管理人員 |
? 專題培訓服務
序號 | 培訓項目 | 主要內(nèi)容 | 培訓人員 |
1 | 美國醫(yī)療器械管理概況 | ■醫(yī)療器械管理機構 ■FDA管理部門組織結構圖 ■法律法規(guī) ■分類管理 ■510K和PMA | 部門主管、文件編寫員 |
2 | 主要的質(zhì)量管理法規(guī)、標準及其關系 | ■ISO13485-質(zhì)量管理體系 ■ISO9001-質(zhì)量管理體 ■標準與法規(guī)的關系 ■ISO13485與QSR820的差異對比 ■如何由ISO13485體系提升到滿足QSR820體系 | 部門主管、文件編寫員 |
3 | QSR的基本內(nèi)容及其詳細解讀 | ■820.20 管理職責 ■820.30 設計控制 ■820.40 文檔控制 ■820.50 采購控制 ■820.60 標識和追溯性 ■820.70 生產(chǎn)和過程控制 ■820.80 接收活動 ■820.90 不合格品控制 ■820.100 糾正預防措施 ■820.120~130 標簽和包裝控制 ■820.140~170 搬運、儲存、分發(fā)和安裝 ■820.180 記錄 ■820.200 服務 ■820.250 統(tǒng)計技術 | 各部門主管 |
4 | QSR的七個子系統(tǒng)及其相互關系 | ■設計控制 ■生產(chǎn)和過程的控制 ■原料的控制 ■工具和設備的控制 ■記錄文件和更改的控制 ■糾正預防措施 ■管理 | 各部門主管 |
5 | 糾正與預防措施(CAPA) | ■ISO13485、QS820關于糾正預防措施的要求; ■糾正預防措施實施經(jīng)常遇到的困擾; ■正確理解和掌握糾正、糾正措施、預防措施; ■不合格的來源和報告責任; ■不合格描述; ■原因分析方法和工具; ■解決問題的選方案實施方案 ■效果審計 ■糾正預防措施的分層管理責任制; | 內(nèi)審員、相關部門 |
6 | 過 程 確 認 Process Validation | ■需確認的過程 ■過程確認的方法和工具 ■重新確認 ■回顧性的過程確認 | 中層管理人員 |
7 | DMR/DHF設計控制培訓 | ■ 確定K號產(chǎn)品 ■ 檢查510K文件中產(chǎn)品標簽的一致性 ■ 檢查原設計文件,完善,補充設計文件中評審、驗證、確認部份的證據(jù) ■ 檢查產(chǎn)品設計變更情況,完善變更前的評審及證據(jù)收集 ■ 整理產(chǎn)品DHF文件 | 工程技術人員 |
8 | CAPA系統(tǒng)改善培訓 | 生產(chǎn),品質(zhì),采購,銷售等管理人員培訓 | |
9 | MDR客戶投訴及產(chǎn)品召回培訓 | 銷售,品質(zhì)人員培訓 | |
10 | 電子記錄與電子簽名培訓 | 相關部門管理人員 |
? 體系建立過程服務
序號 | 推行階段 | 金飛鷹公司的主要服務內(nèi)容 |
| 1 | 體系診斷 | 依標準要求,了解和診斷貴公司現(xiàn)有的體系,作為構建新體系的依據(jù)。 |
| 2 | 體系構建 | 依診斷結果,整理貴公司所需要的體系文件清單,并與貴公司各階層負責人討論 |
| 3 | 成立推行小組 | 與貴公司籌組認證推行小組及組織有關骨干人員 |
| 4 | 教育訓練 | 1.FDA及QSR820簡介導入要領; 2.標準條文具體解析; 3.體系文件編寫培訓。 |
| 5 | 體系建立 | 根據(jù)質(zhì)量體系文件和技術文件編寫計劃實施個別指導與集體輔導相結合 |
| 6 | 體系落實執(zhí)行 | 與各部門檢查實施狀況并做必要的修正 |
| 7 | 內(nèi)部質(zhì)量體系審核 | 1.組成審核小組,帶領內(nèi)審員審核體系落實狀況; 2.設計管理評審及外審。 |
| 8 | 現(xiàn)場檢查 | 1.成立現(xiàn)場檢查工作小組 2.聯(lián)系FDA現(xiàn)場考核官; 3.確定現(xiàn)場檢查時間; 4.跟蹤現(xiàn)場檢查審核全過程 5.確定483報告內(nèi)容及制定糾正和預防措施 6.向FDA上報整改資料 7.現(xiàn)場檢查結果跟蹤。 |
全面解決您的研發(fā)、生產(chǎn)、驗收、營銷全流程問題

practical experience
2000多個二、三類醫(yī)械項目經(jīng)驗沉淀,為你分配做過相同案例的實戰(zhàn)老師。
Professional translation
匯聚7大語種專業(yè)翻譯精英,多年醫(yī)械行業(yè)翻譯經(jīng)驗,能準確翻譯專業(yè)名詞及用語。
Software development
強大的軟件研發(fā)團隊,已為集團研發(fā)出成熟的項目管理軟件,可提供軟件定制服務。
Group supply chain
嚴選數(shù)十個優(yōu)秀的醫(yī)械行業(yè)服務機構,可為客戶推薦更實惠的醫(yī)械配套服務。
多次創(chuàng)造二三類高風險產(chǎn)品一次性通過的行業(yè)紀錄
項目狀態(tài):已結案
項目輔導老師:李老師
項目狀態(tài):已結案
項目輔導老師:車老師
項目狀態(tài):已結案
項目輔導老師:王老師
項目狀態(tài):已結案
項目輔導老師:黃老師