香港醫(yī)療器械注冊
目前,該制度為自愿性制度,以后將漸漸過渡到最終立法成為強(qiáng)制制度。
- 立即咨詢
-
全國服務(wù)熱線:
400-888-7587

400-888-7587
? 辦理介紹:
?香港醫(yī)療器械法規(guī),稱為醫(yī)療儀器行政管理制度,該法規(guī)由醫(yī)療器械控制辦公室(MDCO)制定,醫(yī)療器械審批符合管理制度,MDCO有權(quán)把任何視為適當(dāng)?shù)馁Y料納入”表列”,并有權(quán)把表列向公眾開放。
目前,該制度為自愿性制度,以后將漸漸過渡到最終立法成為強(qiáng)制制度。
? 器械分類
按照GHTF標(biāo)準(zhǔn),和風(fēng)險(xiǎn)把醫(yī)療器械分為四級:級別分為I,II,III和IV級,級別越高,監(jiān)管要求越嚴(yán)格。
? 香港醫(yī)療器械注冊的技術(shù)文件準(zhǔn)備:
? 對于非本地區(qū)制造商:
根據(jù)醫(yī)療器械分類規(guī)則對器械進(jìn)行分類。采用GHTF公布的分類規(guī)則,通常,器械的分類與歐盟(EU)中的分類相匹配。非本地制造商將可以利用其在澳大利亞,加拿大,歐盟,日本或美國的現(xiàn)時(shí)有效上市許可證明。
I類器械沒有注冊過程,也無法注冊(即使是自愿注冊)。您可以直接上市I類器械。以下所有說明將參考II,III和IV類器械的過程。
第一步:
找到一家合資格的當(dāng)?shù)毓咀鳛楸镜刎?fù)責(zé)人(LRP),LRP將負(fù)責(zé)協(xié)調(diào)您的申請和提交以及上市后的警戒活動,假如非本地制造商在香港設(shè)有分公司,與海外制造商同名,也可作為LRP。
第二步:
提供澳大利亞,加拿大,歐盟,日本或美國的現(xiàn)時(shí)有效上市許可證明,如CE證書,F(xiàn)DA 510(k)letter。
第三步
準(zhǔn)備填寫申請表,提交CE證書或FDA 510(k) letter副本,ISO 13485證書,技術(shù)文件,文件以中文或英文提供,或隨附中文或英文譯文。
第四步
任命一名香港的授權(quán)進(jìn)口商。
第五步
LPR把申請治療遞交給MDCO.
第六步
MDCO審核申請,并可能要求提供其他文件或澄清,LRP要及時(shí)對MDCO進(jìn)行回復(fù)。
第7步
批準(zhǔn)后,將為醫(yī)療器械分配一個(gè)香港醫(yī)療器械編號,并在官網(wǎng)數(shù)據(jù)庫中列出,批準(zhǔn)有效期為5年,LRP必須在到期前至少3個(gè)月向MDCO提交延續(xù)申請。
? 本地制造商:
第一步
可由本地制造商充當(dāng)本地負(fù)責(zé)人(LRP)。
第二步
建立ISO 13485質(zhì)量管理體系,產(chǎn)品送檢,準(zhǔn)備相關(guān)申請表和技術(shù)文件。
第三步
選擇指定的公告機(jī)構(gòu),簽約,排期。
第四步
公告機(jī)構(gòu)對質(zhì)量管理體系和技術(shù)文件進(jìn)行審核,如有需要,做出整改,出具審核報(bào)告。
第五步
審核批準(zhǔn)后,公告機(jī)構(gòu)頒發(fā)證書。
? 辦理流程 / Processing process
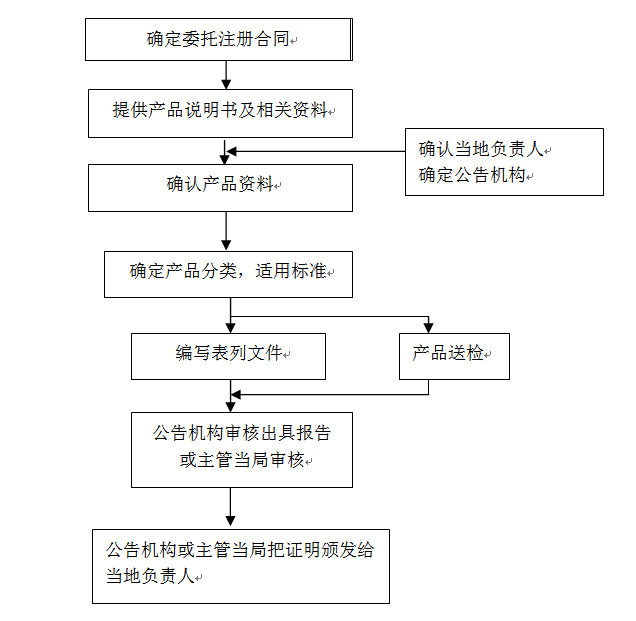
? 官方審核時(shí)間時(shí)間 / Official audit time
| 名稱 | 其他 | 其他 |
| 官方審核時(shí)間 | 為申請人遞交申請及全部所需證明材料 | 12(周) |
? 金飛鷹相關(guān)服務(wù) / Golden Eagle related services
● 通過合作公司提供產(chǎn)品注冊全流程注冊服務(wù)
● 體系認(rèn)證及驗(yàn)廠服務(wù)
● 產(chǎn)品上市后的監(jiān)管服務(wù)
? 自愿性表列的優(yōu)勢 / Voluntary list advantages
●在自愿系統(tǒng)下表列的產(chǎn)品,到了強(qiáng)制性制度時(shí),將直接轉(zhuǎn)移到符合法規(guī)清單中,而無需提交其他文件。
● 如果您不在自愿名單上,并且已開始實(shí)施強(qiáng)制注冊,那么會有很多公司試圖同時(shí)注冊排期,這可能會影響您在香港的銷售。
●醫(yī)院和醫(yī)護(hù)人員更有可能使用在自愿名單上的器械。
● 建議醫(yī)療器械公司現(xiàn)在申請香港的自愿名單。
● 原產(chǎn)地香港表列后的器械,才能夠取得原產(chǎn)地銷售核準(zhǔn)證明,為作為國內(nèi)進(jìn)口醫(yī)療器械辦理注冊的必須文件。
全面解決您的研發(fā)、生產(chǎn)、驗(yàn)收、營銷全流程問題

Team
40多位經(jīng)驗(yàn)豐富的項(xiàng)目專員;
30位5年以上經(jīng)驗(yàn)的項(xiàng)目老師;
4位20年以上經(jīng)驗(yàn)的項(xiàng)目專家;
practical experience
2000多個(gè)二、三類醫(yī)械項(xiàng)目經(jīng)驗(yàn)沉淀,為你分配做過相同案例的實(shí)戰(zhàn)老師。
Professional translation
匯聚7大語種專業(yè)翻譯精英,多年醫(yī)械行業(yè)翻譯經(jīng)驗(yàn),能準(zhǔn)確翻譯專業(yè)名詞及用語。
Software development
強(qiáng)大的軟件研發(fā)團(tuán)隊(duì),已為集團(tuán)研發(fā)出成熟的項(xiàng)目管理軟件,可提供軟件定制服務(wù)。
Group supply chain
嚴(yán)選數(shù)十個(gè)優(yōu)秀的醫(yī)械行業(yè)服務(wù)機(jī)構(gòu),可為客戶推薦更實(shí)惠的醫(yī)械配套服務(wù)。
多次創(chuàng)造二三類高風(fēng)險(xiǎn)產(chǎn)品一次性通過的行業(yè)紀(jì)錄
項(xiàng)目狀態(tài):已結(jié)案
項(xiàng)目輔導(dǎo)老師:李老師
項(xiàng)目狀態(tài):已結(jié)案
項(xiàng)目輔導(dǎo)老師:車?yán)蠋?/p>
項(xiàng)目狀態(tài):已結(jié)案
項(xiàng)目輔導(dǎo)老師:王老師
項(xiàng)目狀態(tài):已結(jié)案
項(xiàng)目輔導(dǎo)老師:黃老師