? 辦理介紹 / Introduction
? FDA QSR820也叫QSR (Quality System Regulation) ,是21 CFR 820的一種簡(jiǎn)易叫法。
?美國(guó)國(guó)會(huì)是法律的制定機(jī)構(gòu).其制定的《聯(lián)邦食品藥品和化妝品法案(Federal Food, Drug and Cosmetic Act)》是美國(guó)關(guān)于醫(yī)療器械管理的最高法律性文件。
?美國(guó)食品藥品監(jiān)督管理局(FDA)是負(fù)責(zé)醫(yī)療器械管理的政府機(jī)構(gòu)。其根據(jù)各相關(guān)法律授權(quán)而制定的各類法規(guī)性的文件編號(hào)為21CFRxxxx(xxxx為阿拉伯?dāng)?shù)字)。 其中21CFR820是FDA根據(jù)<聯(lián)邦食品,藥品和化妝品法案>第501、502、 510、 513、 514、 515、 518、 519、 520、 522、 701、 704、 801、 803條款的授權(quán)而制定的規(guī)范醫(yī)療器械企業(yè)質(zhì)量體系要求的法規(guī),即Quality System Regulation,簡(jiǎn)稱QSR或QSR820。
?QSR 820質(zhì)量體系規(guī)范中描述了現(xiàn)行的生產(chǎn)管理規(guī)范的要求(CGMP)。本規(guī)范要求規(guī)定了所有醫(yī)用器械成品在設(shè)計(jì)、制造、包裝、標(biāo)簽、貯存、安裝和服務(wù)中使用的方法,設(shè)施和控制。這些要求是為了確保醫(yī)療器械成品的安全和有效,并遵從美國(guó)食品藥品和化妝品法。本規(guī)范提出了適用于醫(yī)療器械成品制造商的基本要求,如果某制造商只進(jìn)行本規(guī)范規(guī)定的一部分操作,而不進(jìn)行其他操作,則該制造商僅需執(zhí)行適用于他所進(jìn)行操作的那些要求。有關(guān)1類器械,設(shè)計(jì)控制僅按在§820.30(a)(2)中列出的要求進(jìn)行。這個(gè)規(guī)范不適用于成品組件和零件的制造商,但鼓勵(lì)這樣的制造商使用規(guī)范的適當(dāng)規(guī)定作為指導(dǎo)。
?現(xiàn)行版本的QSR820頒布于1996年10月7日,正式生效于1997年6月1日,亦被稱為美國(guó)醫(yī)療器械行業(yè)的現(xiàn)行良好的規(guī)范(Current Good Manufacture Practice,簡(jiǎn)稱cGMP)。全文一共15個(gè)章節(jié):
A 總則
B 質(zhì)量體系要求
C 設(shè)計(jì)控制
D 文件控制
E 采購(gòu)控制
F 識(shí)別與可追溯性
G 生產(chǎn)于過程控制
H 驗(yàn)收活動(dòng)
I 不合格產(chǎn)品
J 糾正與預(yù)防措施
K 標(biāo)簽與包裝控制
L 搬運(yùn),存儲(chǔ),發(fā)運(yùn)與安裝
M 記錄
N 服務(wù)
O 統(tǒng)計(jì)技術(shù)
?總體而言,這是一套在結(jié)構(gòu)上不同于IS013485要求上與IS013485基本相同,規(guī)定上更加明確的質(zhì)量管理體系法規(guī)。
? 辦理流程 / Processing process
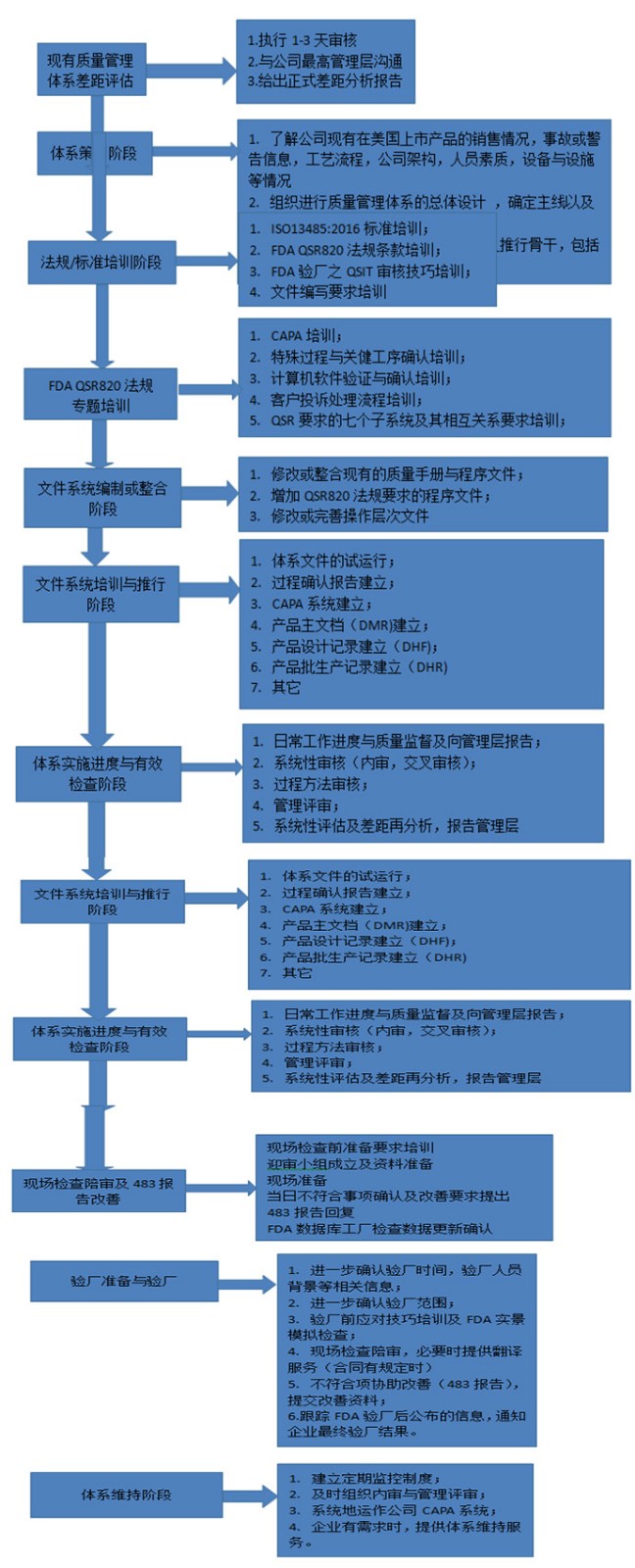
? 金飛鷹相關(guān)服務(wù) / Golden Eagle related services
? 通用培訓(xùn)服務(wù)
序號(hào)
| 培訓(xùn)項(xiàng)目 | 顧問階段 | 培訓(xùn)人員 |
1 | FDA QSR820條文講解與宣貫 | 導(dǎo)入標(biāo)準(zhǔn) | 部門主管、文件編寫員 |
2 | FDAQSR820文件編寫培訓(xùn) | 系統(tǒng)建立 | 部門主管、文件編寫員 |
3 | 質(zhì)量體系文件實(shí)施前培訓(xùn) | 系統(tǒng)建立 | 各部門主管 |
4 | QSR820法規(guī)系列要求培訓(xùn) | 實(shí)施 | 全體人員 |
5 | FDA驗(yàn)廠前應(yīng)對(duì)技巧培訓(xùn) | 實(shí)施 | 內(nèi)審員、相關(guān)部門 |
6 | 管理評(píng)審培訓(xùn) | 實(shí)施 | 中層管理人員 |
7 | 統(tǒng)計(jì)技術(shù)培訓(xùn) | | |
8 | FDAQSR820實(shí)施前動(dòng)員培訓(xùn) | 實(shí)施 | 相關(guān)人員 |
9 | FDAQSR820認(rèn)證前宣貫培訓(xùn) | 取證 | 基層以上管理人員 |
? 專題培訓(xùn)服務(wù)
序號(hào)
| 培訓(xùn)項(xiàng)目 | 主要內(nèi)容 | 培訓(xùn)人員 |
1
| 美國(guó)醫(yī)療器械管理概況 |
■醫(yī)療器械管理機(jī)構(gòu) ■FDA管理部門組織結(jié)構(gòu)圖 ■法律法規(guī) ■分類管理 ■510K和PMA
| 部門主管、文件編寫員 |
2
| 主要的質(zhì)量管理法規(guī)、標(biāo)準(zhǔn)及其關(guān)系 |
■ISO13485-質(zhì)量管理體系 ■ISO9001-質(zhì)量管理體 ■標(biāo)準(zhǔn)與法規(guī)的關(guān)系 ■ISO13485與QSR820的差異對(duì)比 ■如何由ISO13485體系提升到滿足QSR820體系
| 部門主管、文件編寫員 |
3
| QSR的基本內(nèi)容及其詳細(xì)解讀 |
■820.20 管理職責(zé) ■820.30 設(shè)計(jì)控制 ■820.40 文檔控制 ■820.50 采購(gòu)控制 ■820.60 標(biāo)識(shí)和追溯性 ■820.70 生產(chǎn)和過程控制 ■820.80 接收活動(dòng) ■820.90 不合格品控制 ■820.100 糾正預(yù)防措施 ■820.120~130 標(biāo)簽和包裝控制 ■820.140~170 搬運(yùn)、儲(chǔ)存、分發(fā)和安裝 ■820.180 記錄 ■820.200 服務(wù) ■820.250 統(tǒng)計(jì)技術(shù)
| 各部門主管 |
4
| QSR的七個(gè)子系統(tǒng)及其相互關(guān)系 | ■設(shè)計(jì)控制 ■生產(chǎn)和過程的控制 ■原料的控制 ■工具和設(shè)備的控制 ■記錄文件和更改的控制 ■糾正預(yù)防措施 ■管理 | 各部門主管 |
5
| 糾正與預(yù)防措施(CAPA) |
■ISO13485、QS820關(guān)于糾正預(yù)防措施的要求; ■糾正預(yù)防措施實(shí)施經(jīng)常遇到的困擾; ■正確理解和掌握糾正、糾正措施、預(yù)防措施; ■不合格的來源和報(bào)告責(zé)任; ■不合格描述; ■原因分析方法和工具; ■解決問題的選方案實(shí)施方案 ■效果審計(jì) ■糾正預(yù)防措施的分層管理責(zé)任制;
| 內(nèi)審員、相關(guān)部門 |
6
| 過 程 確 認(rèn) Process Validation |
■需確認(rèn)的過程 ■過程確認(rèn)的方法和工具 ■重新確認(rèn) ■回顧性的過程確認(rèn)
| 中層管理人員 |
7 | DMR/DHF設(shè)計(jì)控制培訓(xùn) |
■ 確定K號(hào)產(chǎn)品 ■ 檢查510K文件中產(chǎn)品標(biāo)簽的一致性 ■ 檢查原設(shè)計(jì)文件,完善,補(bǔ)充設(shè)計(jì)文件中評(píng)審、驗(yàn)證、確認(rèn)部份的證據(jù) ■ 檢查產(chǎn)品設(shè)計(jì)變更情況,完善變更前的評(píng)審及證據(jù)收集 ■ 整理產(chǎn)品DHF文件
| 工程技術(shù)人員 |
8
| CAPA系統(tǒng)改善培訓(xùn) |
| 生產(chǎn),品質(zhì),采購(gòu),銷售等管理人員培訓(xùn) |
9
| MDR客戶投訴及產(chǎn)品召回培訓(xùn) |
| 銷售,品質(zhì)人員培訓(xùn) |
10
| 電子記錄與電子簽名培訓(xùn) |
| 相關(guān)部門管理人員 |
? 體系建立過程服務(wù)
序號(hào)
| 推行階段 |
金飛鷹公司的主要服務(wù)內(nèi)容 |
| 1 | 體系診斷 |
依標(biāo)準(zhǔn)要求,了解和診斷貴公司現(xiàn)有的體系,作為構(gòu)建新體系的依據(jù)。
|
| 2 | 體系構(gòu)建 |
依診斷結(jié)果,整理貴公司所需要的體系文件清單,并與貴公司各階層負(fù)責(zé)人討論
|
| 3 | 成立推行小組 |
與貴公司籌組認(rèn)證推行小組及組織有關(guān)骨干人員
|
| 4 | 教育訓(xùn)練 |
1.FDA及QSR820簡(jiǎn)介導(dǎo)入要領(lǐng); 2.標(biāo)準(zhǔn)條文具體解析; 3.體系文件編寫培訓(xùn)。
|
| 5 | 體系建立 |
根據(jù)質(zhì)量體系文件和技術(shù)文件編寫計(jì)劃實(shí)施個(gè)別指導(dǎo)與集體輔導(dǎo)相結(jié)合
|
| 6 | 體系落實(shí)執(zhí)行 |
與各部門檢查實(shí)施狀況并做必要的修正
|
| 7 | 內(nèi)部質(zhì)量體系審核 |
1.組成審核小組,帶領(lǐng)內(nèi)審員審核體系落實(shí)狀況; 2.設(shè)計(jì)管理評(píng)審及外審。
|
| 8 | 現(xiàn)場(chǎng)檢查 |
1.成立現(xiàn)場(chǎng)檢查工作小組 2.聯(lián)系FDA現(xiàn)場(chǎng)考核官; 3.確定現(xiàn)場(chǎng)檢查時(shí)間; 4.跟蹤現(xiàn)場(chǎng)檢查審核全過程 5.確定483報(bào)告內(nèi)容及制定糾正和預(yù)防措施 6.向FDA上報(bào)整改資料 7.現(xiàn)場(chǎng)檢查結(jié)果跟蹤。
|
服務(wù)電話 固話:0755-86194173 手機(jī):13502837139 |
| 在線客服  
| | 營(yíng)銷中心 深圳市南山區(qū)南頭街道前海路3101號(hào)-90振業(yè)國(guó)際商務(wù)中心2401 |
服務(wù)電話 固話:020-82177679/020-82176911 手機(jī):13602603195 | |  |
|
在線客服  
|
|
營(yíng)銷中心 廣州市黃埔區(qū)科學(xué)大道50號(hào)(廣州綠地中央廣場(chǎng))A3棟1906 |






















