歐盟IVDR認證
與大部分國家一樣,歐盟的監(jiān)管體系也是呈“金字塔” 式的多層級法規(guī)體系: 在醫(yī)療領域, 法規(guī)層級從高到低依次為法規(guī)(Regulation)、指令(Directive)、決議(Decision)等
- 立即咨詢
-
全國服務熱線:
400-888-7587

400-888-7587
? IVDR簡介 / Introduction
? 2017年5月5日歐盟體外診斷醫(yī)療器械法規(guī)(IVDR)正式發(fā)布,于2017 年5 月25日正式生效,并于2022 年5 月26 日實施。自實施之日起, IVDR 將取代原歐盟體外診斷設備指令(IVDD)。
? 與大部分國家一樣,歐盟的監(jiān)管體系也是呈“金字塔” 式的多層級法規(guī)體系: 在醫(yī)療領域, 法規(guī)層級從高到低依次為法規(guī)(Regulation)、指令(Directive)、決議(Decision)等,如圖1 所示。
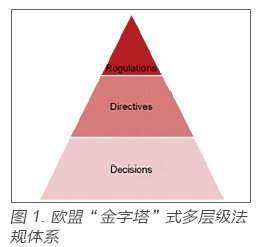
? 本次新發(fā)布的IVDR,在法規(guī)層級上從原先的Directive(指令)上升為Regulation(法規(guī)),標志著歐盟當局對醫(yī)療設備領域監(jiān)管的進一步重視,同時也預示著在歐盟各成員國內醫(yī)療器械監(jiān)管的尺度將得到進一步的統(tǒng)一。
? 分類規(guī)則的變化以及公告機構介入的增加:
?在IVDR法規(guī)中,對于體外診斷設備的監(jiān)管依然是基于分類監(jiān)管這個大框架,但是分類規(guī)則較原先的IVDD卻發(fā)生了根本性的變化,即在IVDR中,基于產品的風險將所有的體外診斷設備由低到高分為了A、B、C、D四類,如圖2 所示:
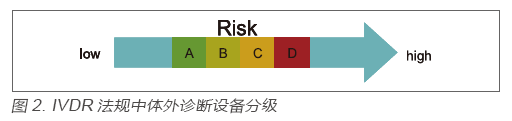
?該分類規(guī)則來源于全球協(xié)調工作組(GHTF),目前加拿大、巴西、澳大利亞等國已使用,是國際范圍內認可度較高的分類規(guī)則。各類產品舉例見表1。

?伴隨著產品分類規(guī)則的調整,各類別產品對應的認證途徑自然較原監(jiān)管體系也有著很大的變化,其中最核心的變化點在于公告機構(Notified Body,NB)介入的增加,涉及產品包括所有的D、C、B類和部分A類。
?在整個IVD領域,涉及公告機構介入的產品數(shù)量從IVDD監(jiān)管體系下的10%~20%增加至80%~90%[2]。告機構介入量的增加,意味著絕大多數(shù)的體外診斷設備,在歐盟區(qū)的市場準入將要告別原先“自我宣稱”的形式,取而代之的將是一個實質性的注冊過程。
? 歐盟醫(yī)療器械數(shù)據(jù)庫的建立以及監(jiān)管透明度的增加:
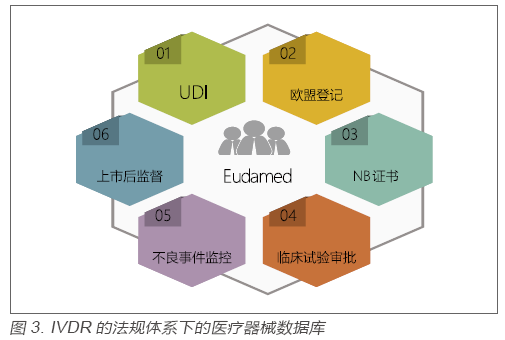
?在歐盟過去十多年的醫(yī)療器械監(jiān)管中,監(jiān)管的透明度一直是業(yè)內詬病比較多的一點。究其原因主要在于沒有一個公開的數(shù)據(jù)庫供各方查詢[3]。在IVDR的法規(guī)體系下,歐盟主管當局一個很重要的工作就是未來將要推出醫(yī)療器械數(shù)據(jù)庫(Eudamed),該數(shù)據(jù)庫涵蓋從產品上市前審批到上市后監(jiān)管中的很多重要信息。見圖3:
。
?在IVDR中還提出了安全和性能摘要(Summary of Safety and Performance)的要求,以進一步增加監(jiān)管的透明度。該要求包括C類和D類的產品需要以摘要的形式,將產品規(guī)格、性能評估結論及臨床試驗結論等信息公開。通過該摘要,一方面使用者可以更清楚地了解產品的性能指標,另一方面生產企業(yè)可以更加詳細地對比同類產品的監(jiān)管尺度[4]。
? 唯一設備識別系統(tǒng)(Unique Device Identification System, UDI)的引入:
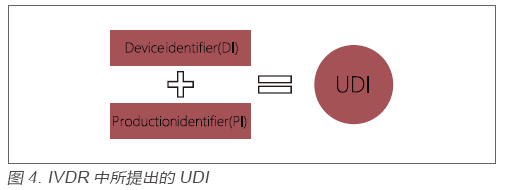
? 繼美國FDA實施UDI的要求以來,世界范圍內紛紛效仿,很多國家相繼推出相關草案。歐盟本次出臺的IVDR,同樣也引入UDI的要求,以增強產品的追溯以及上市后的管理。與FDA的要求一樣,IVDR中所提出的UDI同樣是由一個固定的產品識別碼(Device Identifier,DI)和一個非固定的生產識別碼(Production Identifier,PI)組成,見圖4。生產企業(yè)在實施UDI的過程中,需要明確各產品的UDI代碼及所包含的信息,并在產品上加貼UDI標貼,同時以電子形式存儲UDI相關信息并在Eudamed系統(tǒng)上申報。
? 法規(guī)負責人的提出:
? IVDR法規(guī)中,首次提出了法規(guī)負責人的要求:要求每個制造商企業(yè)內,至少任命一位法規(guī)負責人,負責處理與產品相關的監(jiān)管、合規(guī)性相關工作。具體的職責包括產品批放行、起草和維護CE技術文檔、完成上市后產品的監(jiān)控、臨床試驗相關文件的簽署等。
?提出法規(guī)負責人的要求,標志著新法規(guī)IVDR對于執(zhí)行層面的思考;意味著法規(guī)要求在企業(yè)內的責任明確、落實到人,從生產企業(yè)內部促進著產品的安全性和有效性[5]。
? 過渡期與法規(guī)切換:
? 新法規(guī)IVDR與IVDD相比變化很大,為避免由于法規(guī)切換而造成對現(xiàn)有醫(yī)療系統(tǒng)的沖擊,實現(xiàn)法規(guī)的“軟著陸”,IVDR法規(guī)從生效(Entry into Force)到實施(Application)期間有5年的過渡期。IVDR法規(guī)的生效日為2017年5月25日,實施日為2022年5月26日。在生效日前依照舊法規(guī)IVDD頒發(fā)的CE證書,在證書有效期內持續(xù)有效;在生效日后依照舊法規(guī)IVDD頒發(fā)的CE證書,在實施日后的2 年失效(若證書有效期晚于該時間點)。見圖5。
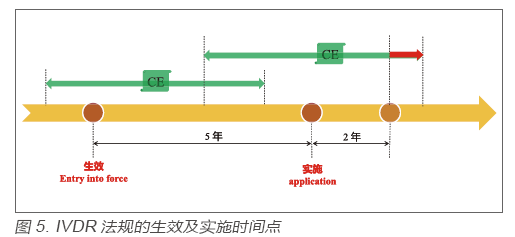
? 所以,在IVDD法規(guī)框架下“自我宣稱”類的產品,由于不涉及CE證書,故需要在實施日前完成IVDR法規(guī)的切換;少部分在IVDD法規(guī)框架下涉及CE證書的產品,需要在證書有效期內完成IVDR法規(guī)的切換,但不得晚于實施之后的2 年。
? 后續(xù):
?歐盟區(qū)是各醫(yī)療器械制造商核心目標市場之一,也是全球第二大的體外診斷設備市場。滿足IVDR法規(guī)的要求對各制造商有著不言而喻的巨大作用,各生廠商在未來的幾年內都需要對此開展緊鑼密鼓的法規(guī)跟蹤及實施工作。
? 辦理流程 / Processing process
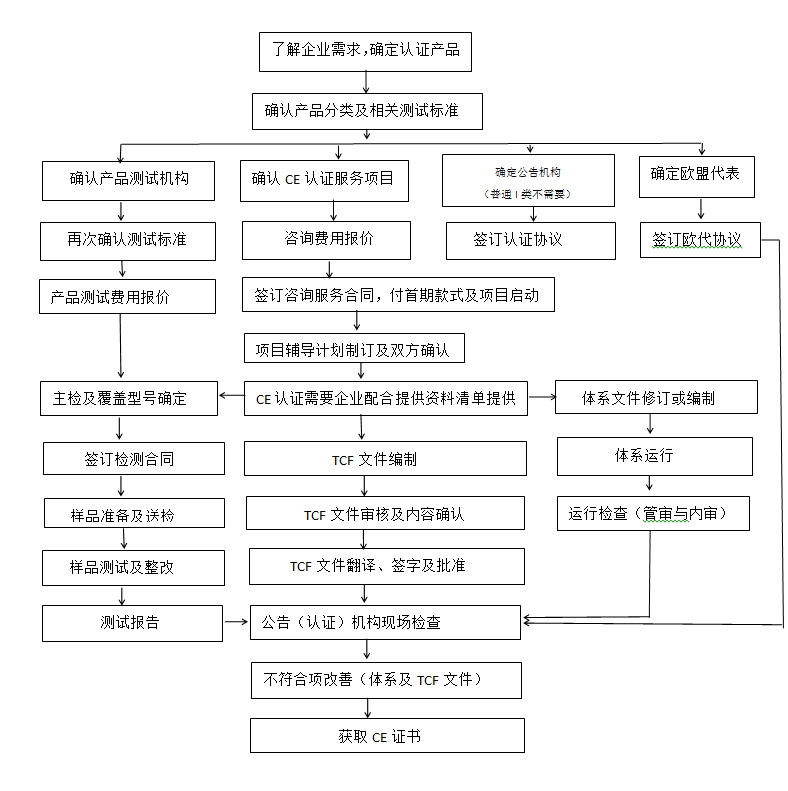
CE認證流程(以93/42/EEC指令為例)
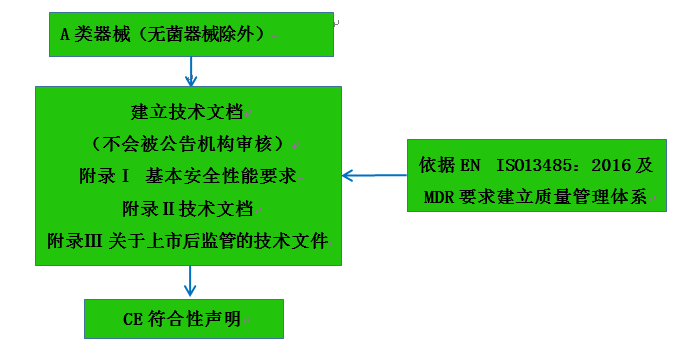
A類器械(無菌除外)認證注冊流程
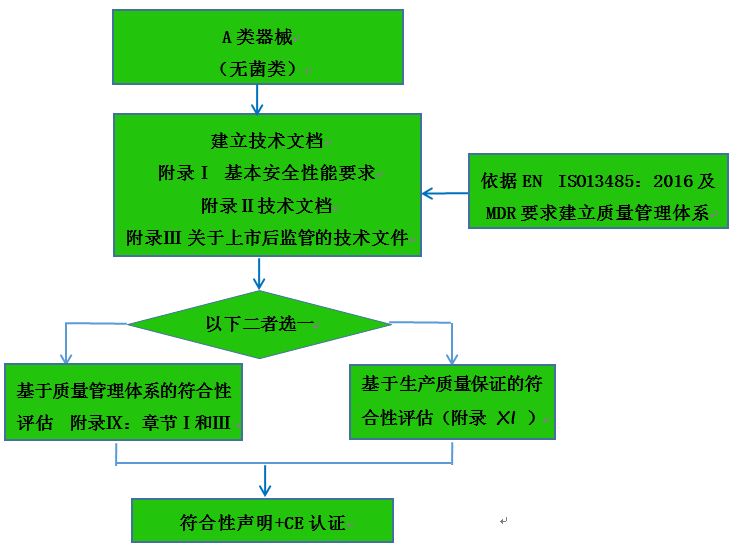
A類器械(無菌類器械)認證注冊流程
B類器械認證注冊流程
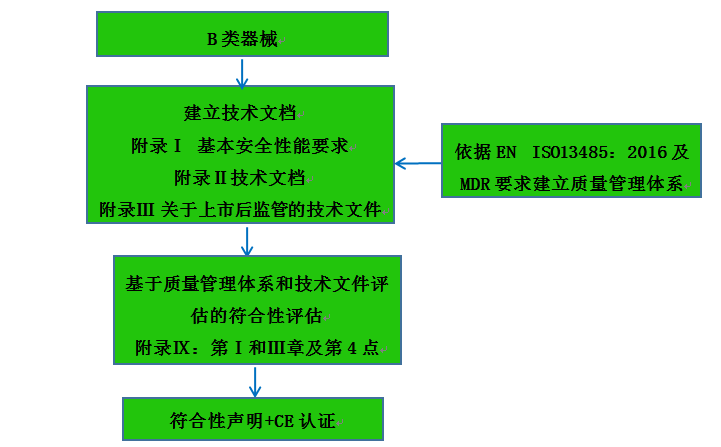
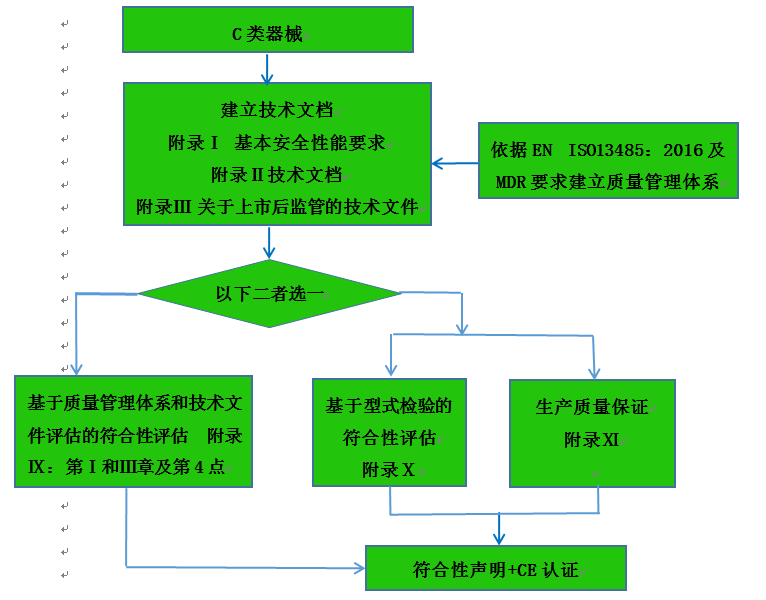
C類器械認證注冊流程
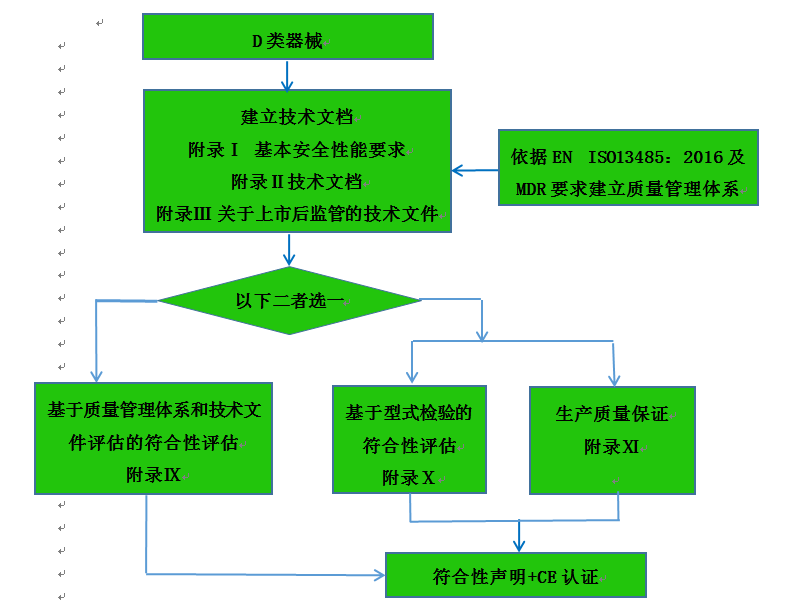
D類器械認證注冊流程
? 金飛鷹相關服務 / Golden Eagle related services
●IVDR法規(guī)培訓 ●公告機構,檢測機構,歐盟代表協(xié)助確認 ●質量管理系統(tǒng)建立與維持檢查 ●產品TCF文件編制,審核與定稿 ●UDI建立輔導 ●現(xiàn)場審核陪審 | ●新法規(guī)下認證產品分類確認 ●試劑說明書,風險管理文件等檢測文件協(xié)助 ●臨床試驗技術支持 ●產品上市后監(jiān)督文件編制 ●商業(yè)保險購買支持 ●TCF文件更新與維護 | ●產品檢測標準確認 ●產品檢測進度跟蹤,檢測不合格項目改善協(xié)助 ●臨床評價文獻編制 ●歐盟數(shù)據(jù)庫填報 ●產品技術文件檔案全文翻譯,包括英,法,德,葡等語種 ●監(jiān)督審核與飛行檢查指導 |
全面解決您的研發(fā)、生產、驗收、營銷全流程問題

practical experience
2000多個二、三類醫(yī)械項目經驗沉淀,為你分配做過相同案例的實戰(zhàn)老師。
Professional translation
匯聚7大語種專業(yè)翻譯精英,多年醫(yī)械行業(yè)翻譯經驗,能準確翻譯專業(yè)名詞及用語。
Software development
強大的軟件研發(fā)團隊,已為集團研發(fā)出成熟的項目管理軟件,可提供軟件定制服務。
Group supply chain
嚴選數(shù)十個優(yōu)秀的醫(yī)械行業(yè)服務機構,可為客戶推薦更實惠的醫(yī)械配套服務。
多次創(chuàng)造二三類高風險產品一次性通過的行業(yè)紀錄
項目狀態(tài):已結案
項目輔導老師:李老師
項目狀態(tài):已結案
項目輔導老師:車老師
項目狀態(tài):已結案
項目輔導老師:王老師
項目狀態(tài):已結案
項目輔導老師:黃老師