歐盟MDR認(rèn)證
- 立即咨詢
-
全國服務(wù)熱線:
400-888-7587

400-888-7587
? 辦理介紹 / Introduction
? 歐洲議會和理事會于2017年4月5日簽發(fā)的關(guān)于醫(yī)療器械第2017/745號法規(guī),并廢除了理事會第90/385/EEC號和第93/42/EEC號指令;歐洲議會和理事會于2017年4月5日簽發(fā)的關(guān)于體外診斷醫(yī)療器械第2017/746號(EU)法規(guī)并廢除了第98/79/EC號指令,兩大法規(guī)于2017年5月5日在歐盟官方公布,并于公布后的三年開始正式實施。與原來的三個指南性文件相比,有以下內(nèi)容的變化:
? 主要變化 :
●擴大了應(yīng)用范圍 ●完善了器械的通用安全和性能要求 ●完善臨床評價相關(guān)要求 ●對NB提出嚴(yán)格的要求 | ●提出了新的概念和器械的定義 ●加強對技術(shù)文件的要求 ●提出Eudamed數(shù)據(jù)庫的建立和使用 | ●細(xì)化了醫(yī)療器械的分類 ●加強器械上市后的監(jiān)管 ●提出器械的可追溯性(UDI) |
?適用范圍擴大
● 新MDR不僅包含了MDD及AIMDD涵蓋的所有產(chǎn)品;還覆蓋專門用于器械的清潔、消毒或滅菌的器械,以及Annex XVI列舉的無預(yù)期醫(yī)療目的的產(chǎn)品,如美瞳、面部填充或注射、紋身、皮膚改善和美容等產(chǎn)品。包含某些藥械結(jié)合產(chǎn)品,詳細(xì)請見Article1(8,9)。包含某些由非活性或處理為非活性的人類來源組織或細(xì)胞衍生物制造的特定產(chǎn)品。包含聲稱僅具有美容目的或另一種非醫(yī)療目的,但在功能和風(fēng)險特征方面類似于醫(yī)療器械的特定產(chǎn)品組聲明納米材料器械屬于MDR范圍,且要接受最為嚴(yán)格的評估程序。包含發(fā)射離子輻射的器械和醫(yī)療用途的軟件。
?DMR提出了新的概念和器械的定義
● MDR中增加了很多新的概念,從MDD中的14個概念,增加到現(xiàn)在的71個,如增加了一些臨床試驗方面和上市后監(jiān)管方面的概念,如 “recall ,withdraw ,serious incident, clinical consent, clinical benefit”.詳情請見Article2 。
?器械的分類變化
● 從MDD到MDR,器械仍分為四大類:I類、IIa類、IIb類、III類。
● MDD中與分類相關(guān)是93/42/EEC中的 Annex IX 和相應(yīng)的指南MEDDEV 2. 4/1 Rev. 9;新的MDR中Article51和Annex VIII 詳細(xì)闡述了產(chǎn)品的分類信息。主要變化是由MDD的“18條”,改為MDR的“22條”。
器械類型 | MDD | MDR |
NON-INVASIVE DEVICES | Rule 1- Rule 4 | Rule 1-Rule 4 |
INVASIVE DEVICES | Rule 5-Rule 8 | Rule 5-Rule 8 |
ACTIVE DEVICES | Rule 9-Rule 12 | Rule 9-Rule 13 |
SPECIAL RULES | Rule 13-Rule 18 | Rule 14-Rule 22 |
● Rule1-Rule 4: NON-INVASIVE DEVICES非侵入性器械
● Rule3: 增加了用于體外直接從人體或人類胚胎取下體外使用的人體細(xì)胞、組織、氣管,然后再植入或注入體內(nèi),此類器械為III類。
● Rule 5-Rule 8:INVASIVE DEVICES侵入性器械。
● Rule 8:在原來的基礎(chǔ)上添加了:有源植入器械或其相關(guān)附件,乳房植入物或心臟修補網(wǎng)狀織物,完整或部分關(guān)節(jié)置換物,直接與脊柱接觸的椎間盤置換植入物為III類。
● Rule 9-Rule 13:ACTIVE DEVICES有源器械
● Rule9:在原來的基礎(chǔ)上增加了“針對治療目的釋放電離輻射的有源器械”以及“用于控制、監(jiān)測或直接影響有源植入式器械”,這兩大類器械均為II b類。
● Rule11:新添加,提出用于提供診斷或治療目的決策信息和監(jiān)測生理過程的軟件,均為II a類;其他軟件類為I類。
● Rule 14-Rule 22:SPECIAL RULES特殊規(guī)則。
● Rule14:進(jìn)一步完善了“衍生自人體血液或血漿的醫(yī)療產(chǎn)品”分類的要求。
● Rule 18:進(jìn)一步完善“利用非活性或處理為非活性的人體或動物源組織或細(xì)胞或其他衍生物制成的器械”的分類要求。
● Rule19:添加對納米材料器械的分類要求。
● Rule20:添加了通過吸入方式,與身體孔口相關(guān)的侵入器械的分類。
● Rule 21:添加了引入人體可吸收物質(zhì)到人體的器械。
● Rule22: 添加了具有集成或合并診斷功能的有源治療器械的分類。
此外還刪除了MDD中對血袋的單獨分類。
? 器械的通用安全和性能要求
● 由MDD中Annex 1 ESSENTIAL REQUIREMENTS 進(jìn)一步完善為“ANNEX I GENERAL SAFETY AND PERFORMANCE REQUIREMENTS”;從原來的13個條款增加到現(xiàn)在的23個,同時MDD中 Article 13: Information supplied by the manufacturer 在MDR中作為一個單獨的章節(jié) “CHAPTER III REQUIREMENTS REGARDING THE INFORMATION SUPPLIED WITH THE DEVICE”。細(xì)化了多條性能要求,強調(diào)將風(fēng)險分析和管理貫穿于設(shè)計和生產(chǎn)、銷售、上市后監(jiān)管等整個產(chǎn)品周期中 。
? 技術(shù)文件的要求
● MDR中添加了對技術(shù)文件內(nèi)容的要求;且明確指出上市后監(jiān)管計劃和安全性更新報告(PSUR)都是技術(shù)文件的一部分,并要求依據(jù)上市后監(jiān)管體系收集的資料對技術(shù)文件中相應(yīng)信息進(jìn)行更新。
? 技術(shù)文件的內(nèi)容
●器械說明與性能指標(biāo) ●通用安全與性能要求 ●包括變型和附件包含器械說明與性能指標(biāo),以及引用的前代和類似器械的信息。 | ●制造商提供的信息 ●包含其符合附錄I提供的通用安全與性能要求的證明資料 ●產(chǎn)品驗證與確認(rèn) | ●設(shè)計與制造信息 ●風(fēng)險利益分析和風(fēng)險管理 ●臨床前和臨床數(shù)據(jù)(包含臨床評價計劃/報告,PMCF計劃/報告);以及針對含藥器械、人體/動物來源組織或其衍生物制備的器械、引入人體并被吸收器械、具有測量功能器械等的相關(guān)附加信息 |
? 上市后監(jiān)管技術(shù)文件
●AnnexIII TECHNICAL DOCUMENTATION ON POST-MARKET SURVEILLANCE 詳細(xì)說明了要按照Article83-86 編寫上市后監(jiān)管的文件,包含上市后監(jiān)管計劃、上市后監(jiān)管報告或定期安全性更新報告(PSUR)。
? 符合性聲明文件
●ANNEX IV EU DECLARATION OF CONFORMITY 詳細(xì)說明了“符合性聲明”文件包含的內(nèi)容。
? 加強器械上市后監(jiān)管體系
●Chapter VII POST-MARKET SURVEILLANCE, VIGILANCE AND MARKET SURVEILLANCE 著重說明上市后監(jiān)管、警戒和市場監(jiān)管。
●建立、實施和維護(hù)上市后監(jiān)管體系(見Article83)。
●強調(diào)上市后監(jiān)管體系貫穿整個生命周期,并不斷更新。
●建立“上市后監(jiān)管計劃”(見Article84),具體內(nèi)容見Annex III。
●I類器械編寫“上市后監(jiān)管報告”(見Article85)。
●IIa、IIb和III類器械編制“定期安全性更新報告(PSUR)”(見Article86)。
●PSUR需定期更新并作為技術(shù)文件的一部分。
●建立警戒和上市后監(jiān)管電子系統(tǒng)(見Article 92)。
●在整個器械使用壽命期間,依據(jù)實施PMCF后取得的臨床數(shù)據(jù)對臨床評價及技術(shù)文件進(jìn)行更新(Annex XIV part B)。
? 完善臨床評價相關(guān)要求
新法規(guī)提出:
●要求根據(jù)Article61和附錄XIV partA執(zhí)行、評估、報告和更新臨床評價資料;
●提出對特定III類和IIb類器械,CER中要考慮咨詢專家小組的意見;
●對植入和III類器械,提出考慮臨床研究;
●要求CER按照PMCF取得數(shù)據(jù)進(jìn)行更新;
●針對III類和可植入器械,提出了CER更新的頻率;
●明確證明實質(zhì)等同性需考慮的特點;
●要求其與風(fēng)險管理的相互作用
? Eudamed數(shù)據(jù)庫
●明確歐洲醫(yī)療器械數(shù)據(jù)庫(Eudamed)建立目的和包含的信息(Article 33);
? 信息的公開性
●要求III類器械和植入式器械,安全和臨床性能信息通過Eudamed向公眾開放。
●提出器械的可追溯性(UDI)
●除定制和研究器械外,其他器械均需建立UDI系統(tǒng);
●UDI信息體現(xiàn)在標(biāo)簽或包裝上(不包含集裝箱);
●UDI-DI信息需要載明于符合性聲明中(見Article27);
●Annex VI Part B提出UDI-DI包含的信息;
●可植入、重復(fù)使用、軟件、可配置器械的UDI有特殊要求(見Annex VI Part C)
●包裝或標(biāo)簽上UDI實施的時間見Article123 (f)。
●UDI 發(fā)行實體由歐盟委員會指定。
●過渡性:Article 120指出“在委員會根據(jù)第27(2)條指定發(fā)行實體前,GS1、HIBCC和ICCBBA應(yīng)被視為指定的發(fā)行實體”。
? 對NB提出的嚴(yán)格要求
●對“公告機構(gòu)”,新版MDR花費大篇幅對其進(jìn)行職能和要求進(jìn)行描述;各NB需按照附錄VII的要求重新申請MDR的三方審核的授權(quán);
? 其它變化
●EU還對一次性使用器械及其再處理(Article17)和給患者的植入器械植入物卡(Article18)提出了要求;
? 辦理流程 / Processing process
CE認(rèn)證流程(以93/42/EEC指令為例)
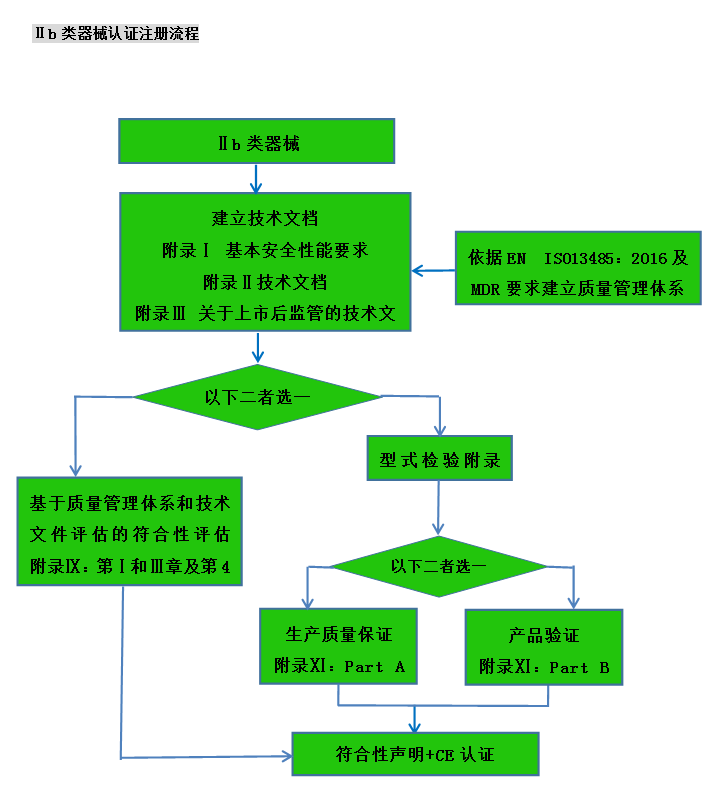
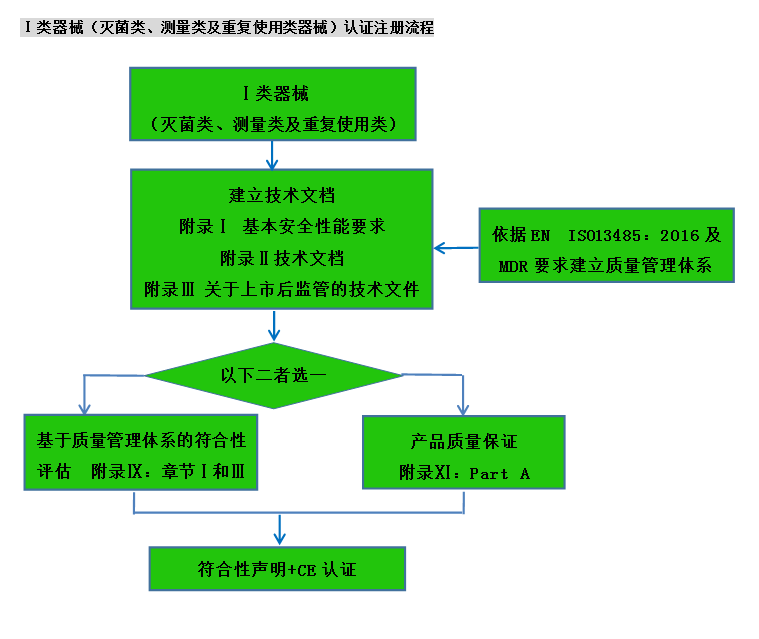
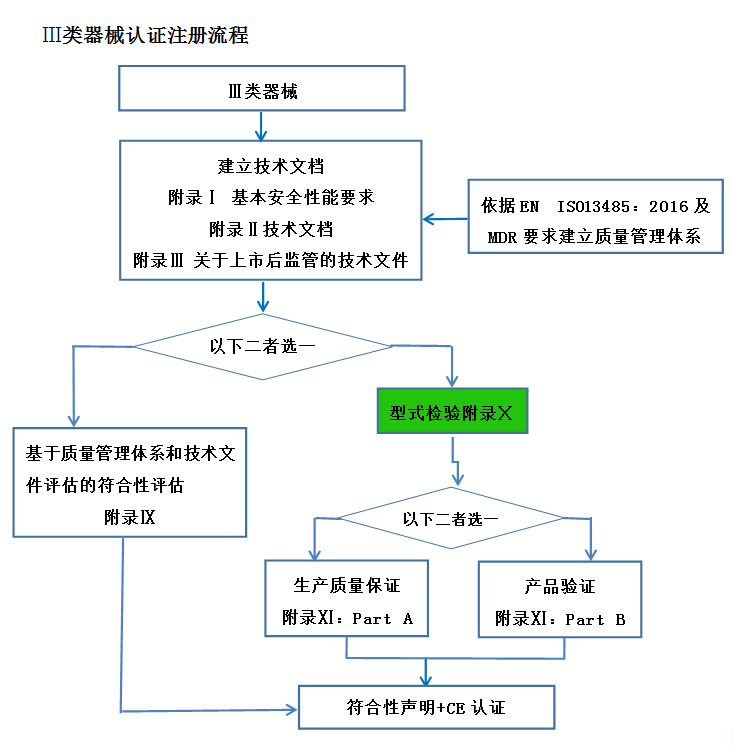
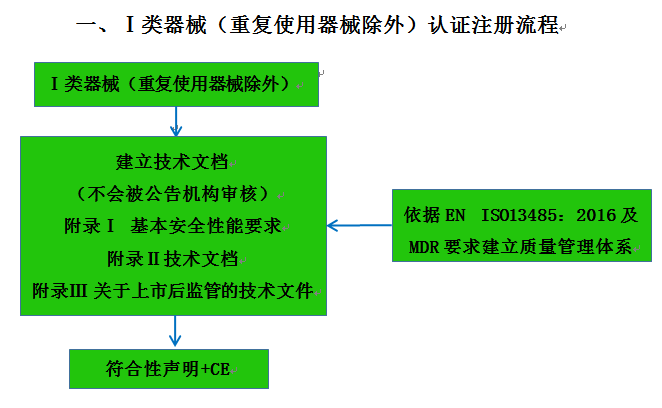
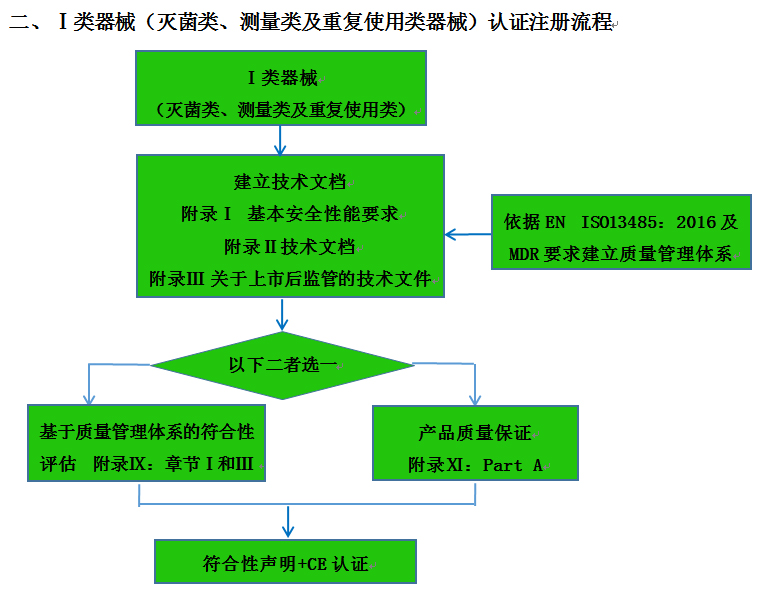
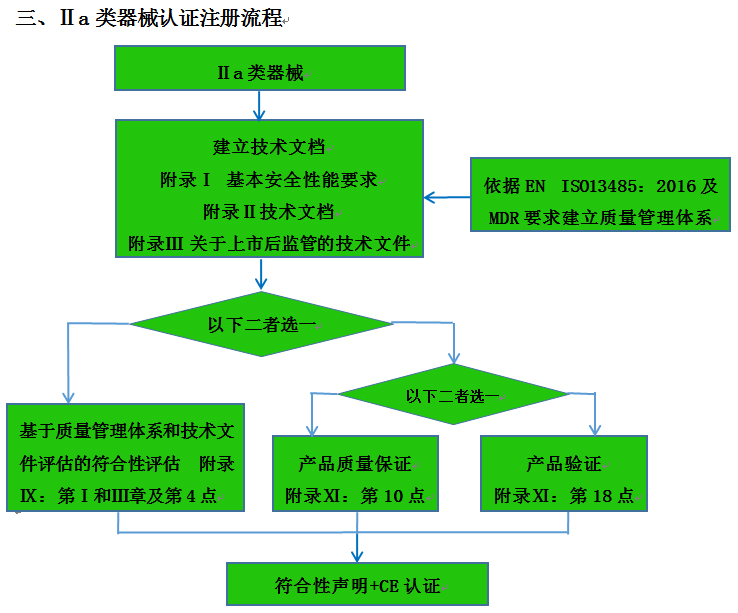
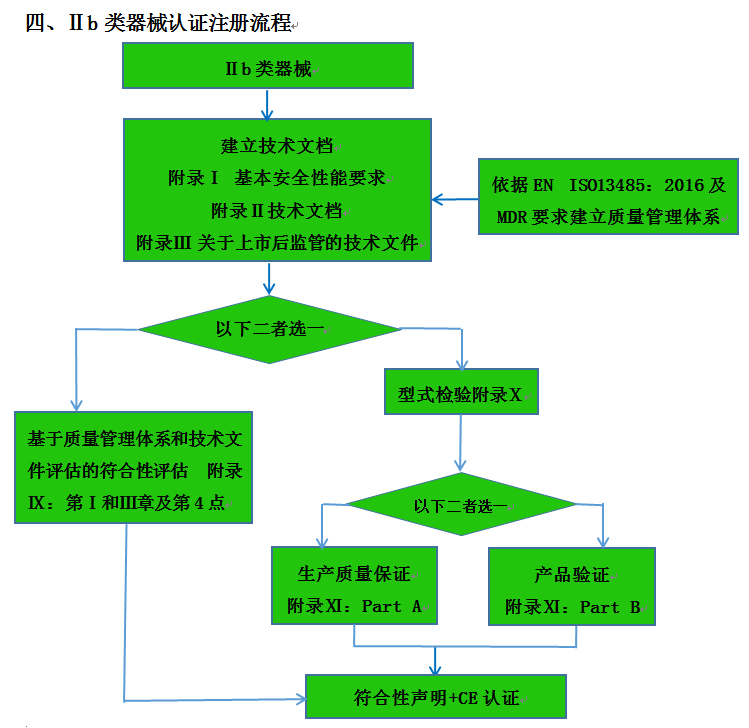
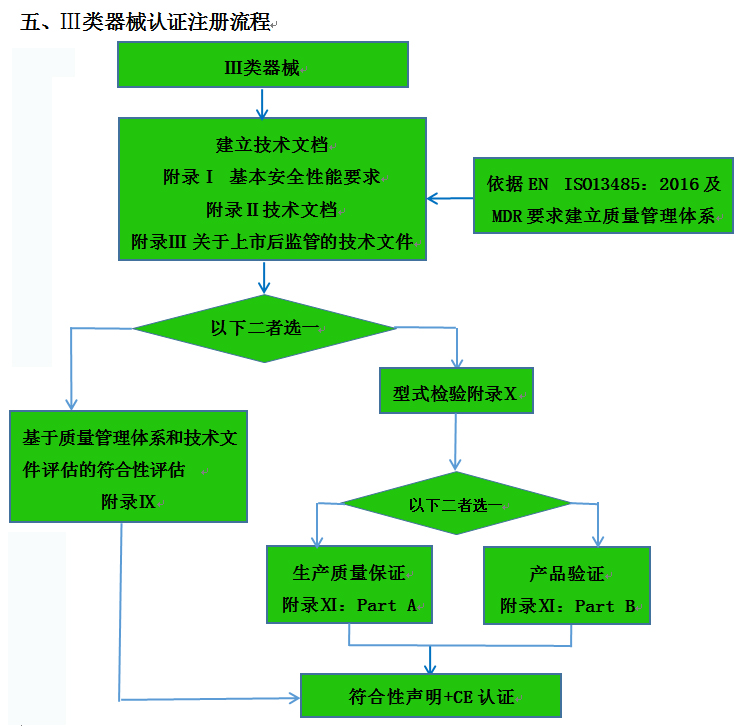
? 金飛鷹相關(guān)服務(wù) / Golden Eagle related services
●MDR法規(guī)培訓(xùn) ●公告機構(gòu),檢測機構(gòu),歐盟代表協(xié)助確認(rèn) ●質(zhì)量管理系統(tǒng)建立與維持檢查 ●產(chǎn)品TCF文件編制,審核與定稿 ●UDI建立輔導(dǎo) ●現(xiàn)場審核陪審 | ●認(rèn)證產(chǎn)品分類確認(rèn) ●說明書,風(fēng)險管理文件等檢測文件協(xié)助 ●對比產(chǎn)品查找與確認(rèn) ●產(chǎn)品上市后監(jiān)督文件編制 ●商業(yè)保險購買支持 ●TCF文件更新與維護(hù) | ●產(chǎn)品檢測標(biāo)準(zhǔn)確認(rèn) ●產(chǎn)品檢測進(jìn)度跟蹤,檢測不合格項目改善協(xié)助 ●臨床評價文獻(xiàn)編制 ●歐盟數(shù)據(jù)庫填報 ●產(chǎn)品技術(shù)文件檔案全文翻譯,包括英,法,德,葡等語種 ●監(jiān)督審核與飛行檢查指導(dǎo) |
全面解決您的研發(fā)、生產(chǎn)、驗收、營銷全流程問題

practical experience
2000多個二、三類醫(yī)械項目經(jīng)驗沉淀,為你分配做過相同案例的實戰(zhàn)老師。
Professional translation
匯聚7大語種專業(yè)翻譯精英,多年醫(yī)械行業(yè)翻譯經(jīng)驗,能準(zhǔn)確翻譯專業(yè)名詞及用語。
Software development
強大的軟件研發(fā)團隊,已為集團研發(fā)出成熟的項目管理軟件,可提供軟件定制服務(wù)。
Group supply chain
嚴(yán)選數(shù)十個優(yōu)秀的醫(yī)械行業(yè)服務(wù)機構(gòu),可為客戶推薦更實惠的醫(yī)械配套服務(wù)。
多次創(chuàng)造二三類高風(fēng)險產(chǎn)品一次性通過的行業(yè)紀(jì)錄
項目狀態(tài):已結(jié)案
項目輔導(dǎo)老師:李老師
項目狀態(tài):已結(jié)案
項目輔導(dǎo)老師:車?yán)蠋?/p>
項目狀態(tài):已結(jié)案
項目輔導(dǎo)老師:王老師
項目狀態(tài):已結(jié)案
項目輔導(dǎo)老師:黃老師