二類醫(yī)療器械進口延續(xù)注冊
- 立即咨詢
-
全國服務熱線:
400-888-7587

400-888-7587
? 辦理條件 / Conditions
申請人應為境外依法進行登記的生產企業(yè),且該醫(yī)療器械已在注冊申請人注冊地或者生產地址所在國家(地區(qū))已獲準上市銷售。
政府官方原文鏈接:
http://samr.cfda.gov.cn/WS01/CL1768/152055.html
? 申請材料清單 / List of application materials
1、申請表 2、證明性文件 3、關于產品沒有變化的聲明 4、原醫(yī)療器械注冊證及其附件的復印件、歷次醫(yī)療器械注冊變更文件復印件 | 5、注冊證有效期內產品分析報告 6、產品檢驗報告 7、符合性聲明 8、其他 如在原醫(yī)療器械注冊證有效期內發(fā)生了涉及產品技術要求變更的,應當提交依據注冊變更文件修改的產品技術要求一式兩份。 |
? 辦理流程 / Processing process
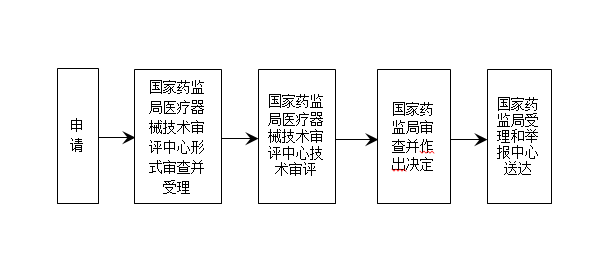
? 廣東政務局服務承諾時間 / Service Commitment Time of Guangdong Government Bureau
名稱 | 其他 | 時限 |
受理 | 3(工作日) | |
審查 | 2類(60工作日) | 3類(90工作日) |
行政許可決定 | 20(工作日) | |
送達 | 10(工作日) |
? 辦理依據 / Processing basis
1. 法律法規(guī)名稱:《醫(yī)療器械監(jiān)督管理條例》 依據文號:(國務院令第650號)第十五條:醫(yī)療器械注冊證有效期為5年。有效期屆滿需要延續(xù)注冊的,應當在有效期屆滿6個月前向原注冊部門提出延續(xù)注冊的申請。 | 2. 法律法規(guī)名稱:《國家食品藥品監(jiān)督管理總局關于調整部分醫(yī)療器械行政審批事項審批程序的決定》 依據文號:(局令第32號) |
? 金飛鷹相關服務 / Golden Eagle related services
●延續(xù)注冊條件確認 ●國內代理人服務 ●進口產品國外上市有效性核查 ●產品分類確認或申報 ●注冊單元確認 ●產品技術要求確認 ●產品樣品送檢文件準備 | ●產品送檢及檢驗報告跟蹤 ●原生產廠家所需要資料清單提供及要求 ●原生產廠家資料審核及公證 ●原生產廠家提供國外監(jiān)床數據審核 ●臨床評價或臨床試驗CRO ●臨床試驗備案 | ●注冊資料申報 ●注冊資料遞交 ●注冊資料發(fā)補 ●注冊專家答辯資料準備 ●產品注冊專家答辯模擬 ●與政府主管機構聯(lián)絡及技術咨詢 ●注冊證進度跟蹤 |
? 結果樣本 / Results the sample

全面解決您的研發(fā)、生產、驗收、營銷全流程問題

practical experience
2000多個二、三類醫(yī)械項目經驗沉淀,為你分配做過相同案例的實戰(zhàn)老師。
Professional translation
匯聚7大語種專業(yè)翻譯精英,多年醫(yī)械行業(yè)翻譯經驗,能準確翻譯專業(yè)名詞及用語。
Software development
強大的軟件研發(fā)團隊,已為集團研發(fā)出成熟的項目管理軟件,可提供軟件定制服務。
Group supply chain
嚴選數十個優(yōu)秀的醫(yī)械行業(yè)服務機構,可為客戶推薦更實惠的醫(yī)械配套服務。
多次創(chuàng)造二三類高風險產品一次性通過的行業(yè)紀錄
項目狀態(tài):已結案
項目輔導老師:李老師
項目狀態(tài):已結案
項目輔導老師:車老師
項目狀態(tài):已結案
項目輔導老師:王老師
項目狀態(tài):已結案
項目輔導老師:黃老師