? 辦理條件 / Conditions
申請醫(yī)療器械注冊證書登記事項變更的申請人,應符合以下條件:
1、廣東省藥品監(jiān)督管理局發(fā)放的醫(yī)療器械注冊證,注冊證在有效期內(nèi)。
2、注冊人名稱和住所、代理人名稱和住所發(fā)生變化的,注冊人應當向原注冊部門申請登記事項變更;境內(nèi)醫(yī)療器械生產(chǎn)地址變更的,注冊人應當在相應的生產(chǎn)許可變更后辦理注冊登記事項變更。
3、納入廣東省醫(yī)療器械注冊人制度試點的注冊申請人還應同時符合以下條件:
(1)住所位于廣州、深圳、珠海市轄區(qū)范圍內(nèi),可以是企業(yè)、研發(fā)機構和科研人員
(2)委托在廣東省行政區(qū)域內(nèi)依法設立的企業(yè)生產(chǎn)本產(chǎn)品;
(3)應當配備專職的法規(guī)事務、質(zhì)量管理、上市后事務等相關人員,以上人員應具有相應的專業(yè)背景和工作經(jīng)驗;
(4)具備醫(yī)療器械全生命周期管理能力,有對質(zhì)量管理體系進行評估、審核和監(jiān)督的人員和條件;
(5)具備承擔醫(yī)療器械質(zhì)量安全責任的能力,確保研制過程規(guī)范,所有數(shù)據(jù)真實、完整、可追溯。
(6)質(zhì)量誠信良好,未有失信記錄,未被納入廣東省藥品監(jiān)管“黑名單”。
政府官方原文鏈接:
http://www.gdzwfw.gov.cn/portal/guide/11440000MB2D034421244017201500502
? 申請材料清單 / List of application materials
1、醫(yī)療器械注冊變更申請表 2、證明性文件 3、注冊人關于變更情況的聲明 4、原醫(yī)療器械注冊證及附件復印件、歷次醫(yī)療器械注冊變更文件復印件 | 5、關于變更情況的申報資料要求 6、符合性聲明 7、告知承諾制審批承諾書 |
? 辦理流程 / Processing process
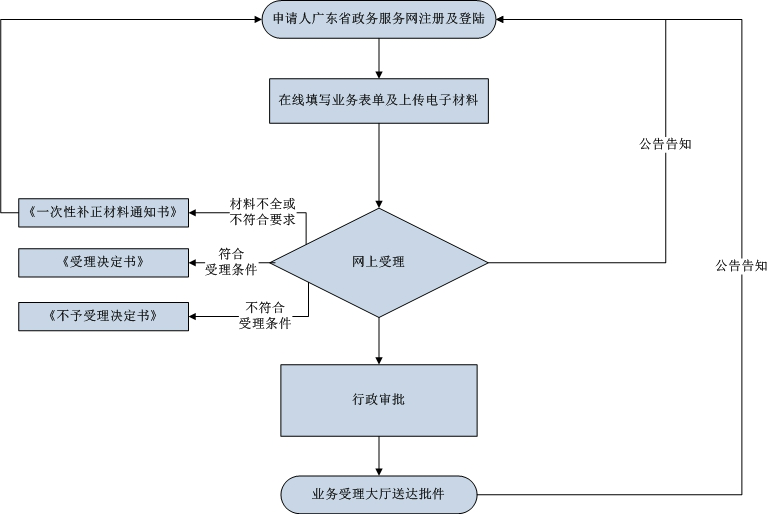
? 辦理依據(jù) / Processing basis
1. 法律法規(guī)名稱:《醫(yī)療器械監(jiān)督管理條例》 依據(jù)文號:2017年國務院令第680號修訂第八條、第十一條 2. 法律法規(guī)名稱:《醫(yī)療器械注冊管理辦法》 依據(jù)文號:2014年國家食品藥品監(jiān)督管理總局令第4號 第五條、第三十七條、第五十條 | 3. 法律法規(guī)名稱:國家藥品監(jiān)督管理局關于同意開展醫(yī)療器械注冊人制度試點工作的批復 依據(jù)文號:國藥監(jiān)函〔2018〕42號第一條 4. 法律法規(guī)名稱:廣東省食品藥品監(jiān)督管理局關于印發(fā)《廣東省醫(yī)療器械注冊人制度試點工作實施方案》的通知 依據(jù)文號:粵食藥監(jiān)局許〔2018〕77號 條款號 三 |
? 金飛鷹相關服務 / Golden Eagle related services
●注冊證登記事項確認 ●產(chǎn)品分類確認或申報 ●注冊單元確認 ●創(chuàng)新醫(yī)療器械申報 ●產(chǎn)品技術要求確認 ●產(chǎn)品樣品送檢文件準備 ●產(chǎn)品送檢及檢驗報告跟蹤 ●生產(chǎn)廠房規(guī)劃及平面圖設計 ●產(chǎn)品研發(fā)過程輔導 ●生產(chǎn)設備及檢驗設備、設施清單確定 ●無菌或無塵廠房設施驗證 |
●滅菌工藝驗證 ●包裝工藝驗證 ●特殊過程驗證 ●注冊資料申報 ●注冊資料遞交 ●人員培訓 ●體系考核申報資料準備 ●何等考核申報資料遞交 ●質(zhì)量管理體系文件編制 ●產(chǎn)品技術文檔建立 ●體系考核現(xiàn)場檢查預檢查
|
●體系考核后不符合項改善 ●注冊資料發(fā)補 ●臨床試驗CRO ●臨床試驗備案 ●注冊人制度質(zhì)量協(xié)議 ●委托方資格申核 ●委托方委托合同 ●企業(yè)委托設計 ●產(chǎn)品注冊專家答辯資料準備 ●產(chǎn)品注冊專家答辯模擬 ●與政府主管機構聯(lián)絡及技術咨詢 |
? 結果樣本 / Results the sample

服務電話 固話:0755-86194173 手機:13502837139 |
| 在線客服  
| | 營銷中心 深圳市南山區(qū)南頭街道前海路3101號-90振業(yè)國際商務中心2401 |
服務電話 固話:020-82177679/020-82176911 手機:13602603195 | |  |
|
在線客服  
|
|
營銷中心 廣州市黃埔區(qū)科學大道50號(廣州綠地中央廣場)A3棟1906 |























