? 辦理?xiàng)l件 / Conditions
在美國(guó),對(duì)于沒(méi)有合法上市對(duì)比產(chǎn)品的器械,即使屬于中低風(fēng)險(xiǎn),仍然無(wú)法通過(guò)510(k)
申請(qǐng)途徑建立實(shí)質(zhì)等同,獲得上市許可。針對(duì)這類(lèi)產(chǎn)品,F(xiàn)DA于多年前建立了De Novo申報(bào)途徑,對(duì)產(chǎn)品進(jìn)行普通控制或特殊控制,避免按照最高類(lèi)別III類(lèi)申報(bào),給企業(yè)降低負(fù)擔(dān),以便患者能夠及時(shí)獲得安全有效的器械。
De nove 途徑于1997年加入到食品和藥物管理局現(xiàn)代化法案(Food and Drug Administration Modernization Act, FDAMA)中,為在進(jìn)行上市前通告510(K) 申請(qǐng)時(shí)收到“非實(shí)質(zhì)等同”(NSE)而自動(dòng)歸為III類(lèi)的低到中等風(fēng)險(xiǎn)的新型器械提供一個(gè)新的流程,任何企業(yè)在進(jìn)行510(k)申請(qǐng)的時(shí)候收到NSE通知后30天內(nèi),都可以向FDA提交De Novo請(qǐng)求,根據(jù)風(fēng)險(xiǎn)評(píng)估對(duì)器械分類(lèi)成I類(lèi)或者II類(lèi)。
2012年7月9日,根據(jù)食品和藥品監(jiān)督管理局安全和創(chuàng)新法案(Food and Drug Administration Safety and Innovation Act, FDASIA)607章修訂的FD&C法案的513 (f) (2)章節(jié),為企業(yè)提供了一個(gè)新選擇,如果企業(yè)已經(jīng)確定沒(méi)有與他們的產(chǎn)品已上市的等價(jià)器械,不需要先提交510 (k) 申請(qǐng),可以直接向FDA提交De Novo請(qǐng)求,根據(jù)風(fēng)險(xiǎn)評(píng)估對(duì)器械分類(lèi)成I類(lèi)或者II類(lèi)。
該申請(qǐng)途徑實(shí)施至今,已經(jīng)有235種器械通過(guò)此途徑上市,其中2012年以后有170種。
FDA本次發(fā)布的De Novo分類(lèi)規(guī)則新草案更加透明有效地闡明了在該路徑中提交文件的需求和FDA審核的過(guò)程,例如,擬議的法規(guī)和要求將提供關(guān)于重新分類(lèi)過(guò)程的結(jié)構(gòu)、清晰度和透明度,包括與重新分類(lèi)請(qǐng)求的格式和內(nèi)容有關(guān)的要求,以及接受、批準(zhǔn)、拒絕和撤回重新分類(lèi)請(qǐng)求的過(guò)程和標(biāo)準(zhǔn)。如果最終確定,將有助于對(duì)新型醫(yī)療設(shè)備進(jìn)行適當(dāng)分類(lèi),使設(shè)備開(kāi)發(fā)商能夠利用這一路徑開(kāi)發(fā)更多的新型設(shè)備。
De Novo路徑使得更多符合現(xiàn)代性能安全標(biāo)準(zhǔn)的新型器械上市,并可以作為510 (k) 申請(qǐng)路徑實(shí)質(zhì)等同評(píng)價(jià)的對(duì)比產(chǎn)品,有利于FDA正在進(jìn)行中的510 (k) 改革。與此同時(shí),F(xiàn)DA也會(huì)采取新的方法,促進(jìn)在510(k)路徑的實(shí)質(zhì)等同對(duì)比過(guò)程中使用更加現(xiàn)代的對(duì)比產(chǎn)品,從而又促進(jìn)更多的器械采用De Novo途徑。
FDA已經(jīng)發(fā)布新的De Novo指南,指南將幫助FDA更好的監(jiān)管新技術(shù),既能夠保護(hù)患者,同時(shí)促進(jìn)創(chuàng)新技術(shù)改善人們的健康狀況。
De Novo Request申請(qǐng)適合于當(dāng)前無(wú)法找到實(shí)質(zhì)等同產(chǎn)品且其安全和有效性可通過(guò)一般和特殊控制來(lái)保證的產(chǎn)品。鑒于這類(lèi)申請(qǐng)的特殊性,F(xiàn)DA建議在正式提交前先進(jìn)行預(yù)提交(Pre-submission)。
? 辦理流程 / Processing process
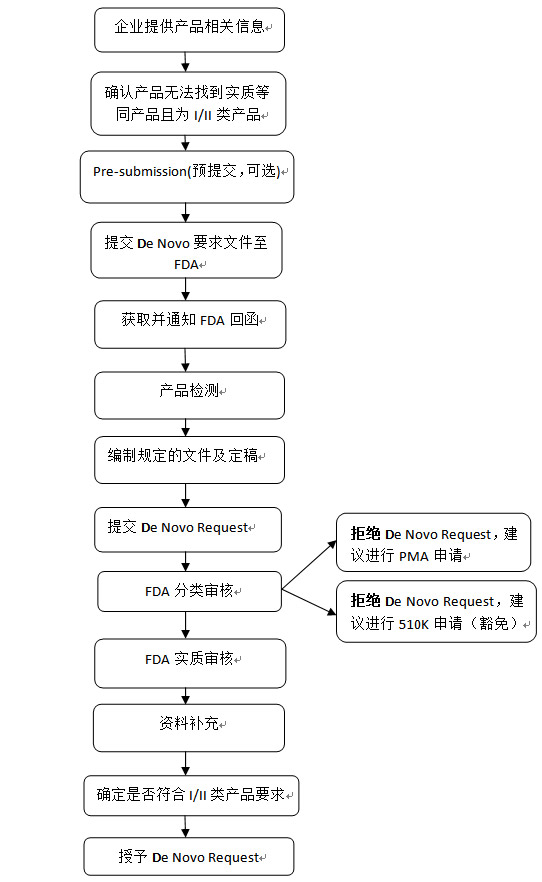
? 行政時(shí)間 / Administration Service Time
名稱(chēng) | 時(shí)限 |
| Pre-submission(可選)資料審核 FDA官方時(shí)間(天) 90天 | FDA官方時(shí)間(天) 90天 |
De Novo classification資料審核 | FDA官方時(shí)間(天) 120天 |
? 金飛鷹相關(guān)服務(wù) / Golden Eagle related services
●確認(rèn)產(chǎn)品是否符合De Novo Request ●準(zhǔn)備De Novo Request申請(qǐng)資料 ●資料遞交與進(jìn)度跟蹤
服務(wù)電話 固話:0755-86194173 手機(jī):13502837139 |
| 在線客服  
| | 營(yíng)銷(xiāo)中心 深圳市南山區(qū)南頭街道前海路3101號(hào)-90振業(yè)國(guó)際商務(wù)中心2401 |
服務(wù)電話 固話:020-82177679/020-82176911 手機(jī):13602603195 | |  |
|
在線客服  
|
|
營(yíng)銷(xiāo)中心 廣州市黃埔區(qū)科學(xué)大道50號(hào)(廣州綠地中央廣場(chǎng))A3棟1906 |






















