? 辦理條件 / Conditions
為了在美國上市醫(yī)療器械,制造商必須經過兩個評估過程其中之一:上市前通知書[510(k)](如果沒有被510(k)赦免),或者上市前批準(PMA)。 大多數(shù)在美國進行商業(yè)分銷的醫(yī)療器械都是通過上市前通知書[510(k)]的形式得到批準的。在某些情況下,在1976年5月28日之前合法上市的器械,既不要求遞交510(k)也不要求遞交PMA。
510(k)文件是向FDA遞交的上市前申請文件,目的是證明申請上市的器械與不受上市前批準(PMA)影響的合法上市器械同樣安全有效,即為等價器械(substantially equivalent)。申請者必須把申請上市的器械與現(xiàn)在美國市場上一種或多種相似器械對比,得出并且支持等價器械的結論。合法上市器械是在1976年5月28日之前合法上市的器械(preamendment device),或者從III類器械中分入II或I類的器械,或者通過510(k)程序發(fā)現(xiàn)與這樣的器械等價的器械,或者通過自動的III 類器械定義的評價建立的器械。與之等價的器械被稱為“predicate device(s)”。 申請者必須提交描述性的數(shù)據,必要的時候,要提交性能數(shù)據來說明器械是predicate device的等價器械。
目前遞交510K文件有三種類型,即:
510(k)上市前通告申請有3種類型
傳統(tǒng)510(k)
簡化510(k)
特殊510(k)
傳統(tǒng)510(k)是21 CFR 807中規(guī)定的原始、完整的申請。特殊510(k)和簡化510(k)申請作為備選申請途徑。FDA指南文件《新的510(k)格式-上市前通告證明實質性等同的替代途徑-最終指南(1998年3月)》清楚地描述了在適當?shù)那闆r下可用于證明實質性等同的兩種替代途徑,可以供不清楚如何遞交510K文件的人員參考。
? 辦理流程 / Processing process
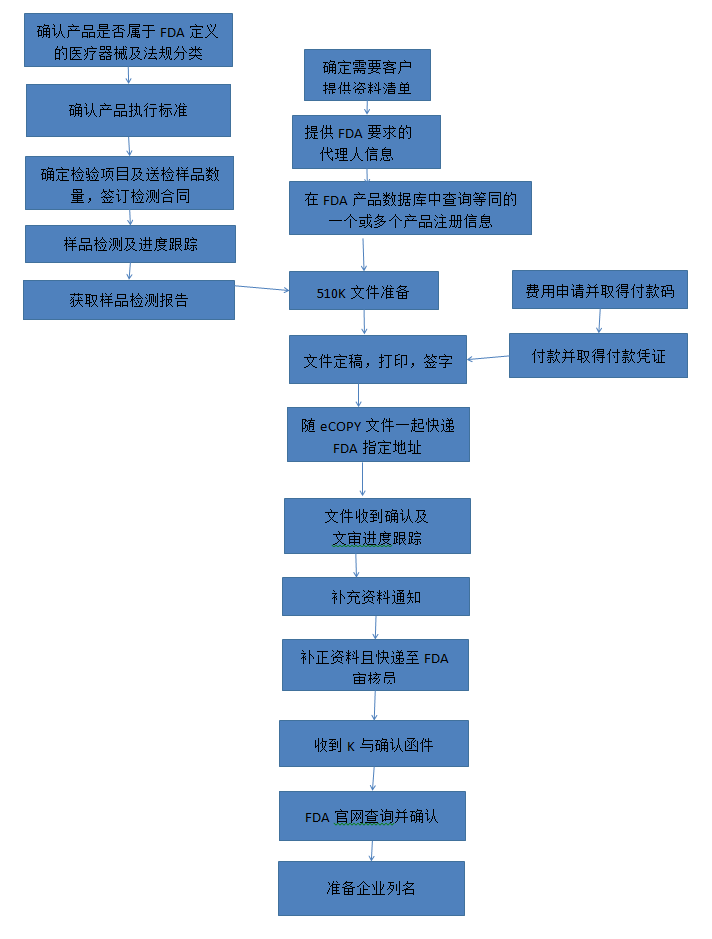
? 金飛鷹相關服務 / Golden Eagle related services
●根據預期用途確定在FDA分類,法規(guī)編號及K文件提交方式等 ●協(xié)助企業(yè)確認產品檢測標準 ●提供FDA代理人服務 ●確定SE產品 ●審核檢測報告 | ●費用申請及付費指導 ●SE文件及其它510K文件編制或審核 ●說明書,標簽要求審核 ●可用性工程方案提供,報告文件編制或審核 ●510K文件遞交 | ●eCOPY遞交 ●審核過程跟蹤 ●補充文件提供編制或審核 ●K號確認 |
服務電話 固話:0755-86194173 手機:13502837139 |
| 在線客服  
| | 營銷中心 深圳市南山區(qū)南頭街道前海路3101號-90振業(yè)國際商務中心2401 |
服務電話 固話:020-82177679/020-82176911 手機:13602603195 | |  |
|
在線客服  
|
|
營銷中心 廣州市黃埔區(qū)科學大道50號(廣州綠地中央廣場)A3棟1906 |






















